题目内容
在一定温度下,将2molA和2molB两种气体混合于2L密闭容器中,发生如下反应:2A(g)+2B(g)?2C(g)+2D(g);2min末反应达到平衡状态,生成0.8molD.请回答下列问题:
(1)B的平衡浓度为 ;A的转化率为 ;
(2)在温度不变时,如果缩小容器体积,平衡体系中混合气体的密度 (填“增大”、“减小”或“不变”).
(3)如果上述反应在相同条件下从逆反应开始进行,最初加C和D各2mol,要使平衡时各物质的体积分数与原平衡相等,则还应加入 molB物质.
(1)B的平衡浓度为
(2)在温度不变时,如果缩小容器体积,平衡体系中混合气体的密度
(3)如果上述反应在相同条件下从逆反应开始进行,最初加C和D各2mol,要使平衡时各物质的体积分数与原平衡相等,则还应加入
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)根据生成D的物质的量,计算参加反应的A、B的物质的量,进而计算平衡时B的物质的量,根据c=
计算B的平衡浓度;
A的转化率=
×100%;
(2)混合气体总质量不变,结合ρ=
判断;
(3)恒温恒容下,最初加C和D各2mol,要使平衡时各物质的体积分数与原平衡相等,则为等效平衡,由于反应前后气体的化学计量数不变,故按化学计量数转化到左边,满足n(A):n(B)=2mol:2mol=1:1.
| n |
| V |
A的转化率=
| 参加反应A的物质的量 |
| 起始投入的A的物质的量 |
(2)混合气体总质量不变,结合ρ=
| m |
| V |
(3)恒温恒容下,最初加C和D各2mol,要使平衡时各物质的体积分数与原平衡相等,则为等效平衡,由于反应前后气体的化学计量数不变,故按化学计量数转化到左边,满足n(A):n(B)=2mol:2mol=1:1.
解答:
解:(1)2min末反应达到平衡状态,生成0.8molD,则参加反应的A、B的物质的量都是0.8mol,
平衡时B的物质的量=2mol-0.8mol=1.6mol,故B的平衡浓度=
=0.8mol/L,
A的转化率=
×100%=40%,
故答案为:0.8mol/L;40%;
(2)混合气体总质量不变,缩小容器体积,结合ρ=
可知平衡体系中混合气体的密度增大,
故答案为:增大;
(3)恒温恒容下,最初加C和D各2mol,要使平衡时各物质的体积分数与原平衡相等,则为等效平衡,由于反应前后气体的化学计量数不变,按化学计量数转化到左边,满足n(A):n(B)=2mol:2mol=1:1,故不需要加入B物质,
故答案为:0.
平衡时B的物质的量=2mol-0.8mol=1.6mol,故B的平衡浓度=
| 1.6mol |
| 2L |
A的转化率=
| 0.8mol |
| 2mol |
故答案为:0.8mol/L;40%;
(2)混合气体总质量不变,缩小容器体积,结合ρ=
| m |
| V |
故答案为:增大;
(3)恒温恒容下,最初加C和D各2mol,要使平衡时各物质的体积分数与原平衡相等,则为等效平衡,由于反应前后气体的化学计量数不变,按化学计量数转化到左边,满足n(A):n(B)=2mol:2mol=1:1,故不需要加入B物质,
故答案为:0.
点评:本题考查化学平衡计算、等效平衡等,难度中等,注意理解等效平衡规律.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
下列方法可以加快锌和稀硫酸反应速率的是( )
| A、加热 | B、加水 |
| C、降温 | D、加入NaOH固体 |
能用离子方程式H++OH-=H2O表示的化学反应是( )
| A、NaOH溶液和醋酸的反应 |
| B、Ba(OH)2溶液和稀H2SO4的反应 |
| C、NaOH溶液和硫酸氢钠溶液反应 |
| D、氨水和稀H2SO4的反应 |
下列有机反应属于氧化反应的是( )
| A、CH2=CH2+Br2→CH2Br-CH2Br | |||
B、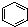 +HNO3 +HNO3
 +H20 +H20 | |||
C、2CH3CH2OH+O2
| |||
D、CH3COOH+CH3CH2OH
|
 电解原理在化学工业中有广泛应用.右图是一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连.请回答下列问题:
电解原理在化学工业中有广泛应用.右图是一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连.请回答下列问题: