题目内容
7.CuSO4溶液是中学化学及工农业生产中常见的一种试剂.(1)某同学配制CuSO4溶液时,向盛有一定量硫酸铜晶体的烧杯中加入适量的蒸馏水,并不断搅拌,结果得到悬浊液.他认为是固体没有完全溶解,于是对悬浊液加热,结果发现浑浊更明显了,随后,他向烧杯中加入了一定量的硫酸溶液,得到了澄清的CuSO4溶液.
(2)该同学利用制得的CuSO4溶液,进行以下实验探究.
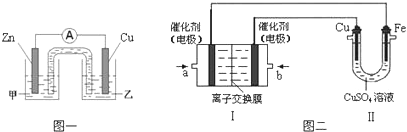
①图一是根据反应Zn+CuSO4═Cu+ZnSO4 设计成的锌铜原电池.Cu极的电极反应式是Cu2++2e-═Cu,盐桥中是含有琼胶的KCl饱和溶液,电池工作时K+向乙移动(填“甲”或“乙”).
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是O2(填“CH4”或“O2”),a处电极上发生的电极反应式是CH4-8e-+10OH-=CO32-+7H2O;当铜电极的质量减轻3.2g,则消耗的CH4在标准状况下的体积为0.28L.
(3)反应一段时间后,燃料电池的电解质溶液完全转化为K2CO3溶液,以下关系正确的是BD.
A.c(K+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C.c(K+)>c(CO32-)>c(H+)>c(OH-)
D.c(K+)>c(CO32-)>c(OH-)>c(HCO3-)
E.c(K+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
分析 (1)硫酸铜溶液中,铜离子水解使得溶液显示酸性;
(2)①在原电池中,正极上是阳离子发生得电子的还原反应,电解质中的阳离子移向正极,阴离子移向负极;
②电镀时,镀件作电解池的阴极,发生还原反应,连接电源的负极;镀层金属铜作电解池的阳极,连接电源的正极;根据电子转移守恒计算甲烷的体积;
(3)A.根据电荷守恒判断;
B.根据质子恒等式判断;
C.K2CO3溶液呈碱性,则c(OH-)>c(H+);
D.溶液中OH-来源于水的电离,HCO3-、CO32-水解,则c(OH-)>c(HCO3-);
E.根据物料守恒判断.
解答 解:(1)硫酸铜溶液中,铜离子水解生成氢氧化铜和硫酸,使得溶液变浑浊,显示酸性,可以加入硫酸来抑制水解,故答案为:硫酸;
(2)①在该原电池中,负极是金属锌,正极是金属铜,正极Cu上是阳离子铜离子发生得电子的还原反应,即Cu2++2e-=Cu,工作时,电解质中的阳离子钾离子移向正极,阴离子移向负极,
故答案为:Cu2++2e-=Cu;乙;
②装置Ⅱ中实现铁上镀铜,金属铁是阴极,金属铜作阳极,a为负极,b为正极,在燃料电池中通入氧气的电极b是正极,a是负极,负极上是燃料发生失去电子的氧化反应,在碱性环境下,甲烷失电子的反应为:CH4+10OH--8e-=CO32-+7H2O,铜电极的质量减轻3.2g时,根据电极反应Cu-2e-=Cu2+,转移电子的量是0.1mol,此时消耗的CH4的体积是$\frac{0.1}{8}$=0.28L,
故答案为:O2;CH4+10OH--8e-=CO32-+7H2O;0.28;
(3)A.电荷不守恒,其电荷守恒为:c(K+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故A错误;
B.溶液中OH-来源于水的电离及CO32-、HCO3-与水的水解反应,每产生1个H2CO3,分子,生成2个OH-,故c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故B正确;
C.K2CO3溶液呈碱性判断,故c(H+)<c(OH-),故C错误;
D.溶液中OH-来源于水的电离,HCO3-、CO32-水解,所以c(OH-)>c(HCO3-),盐类水解很微弱,所以c(CO32-)>c(OH-),故c(K+)>c(CO32-)>c(OH-)>c(HCO3-),故D正确;
E.根据物料守恒c(K+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故E错误;
故答案为:BD.
点评 本题考查原电池和电解原理、离子浓度大小比较等,明确电池反应中元素的化合价变化发生的反应是解答的关键,注意放电顺序的应用及电子守恒,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 铁在潮湿的空气中易腐蚀 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | 往往需要在催化剂条件下SO2氧化成SO3 | |
| D. | H2、I2、HI平衡混和气加压后颜色变深 |
| A. | 标准状况下,2.24 L己烷含有分子的数目为0.1NA | |
| B. | 原子结构示意图: 表示12C,也可以表示13C 表示12C,也可以表示13C | |
| C. | 0.1 mol/L Na2S溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 由离子方程式□□+XO3-+6H+=3X2+3H2O可判断X元素的最高化合价为+5价 |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| A. | 2NaClO+CO2+H2O→Na2CO3+2HClO | |
| B. | HCN+Na2CO3→NaHCO3+NaCN | |
| C. | 结合质子能力由强到弱的顺序为:CO32->HCO3->CH3COO- | |
| D. | 常温下电离常数:Ki2(H2CO3)>Ki(C6H5OH)>Ki(HCN) |
 硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒.取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重如表.回答下列问题:
硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒.取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重如表.回答下列问题:| 温度范围/℃ | 固体质量/g |
| 258~680 | 3.20 |
| 680~1000 | 1.60 |
| 1000以上 | 1.44 |
(2)将硫酸铜晶体加热到258~680℃生成的物质A,A是CuSO4(化学式);A溶于水配成溶液,加入氨水,观察到的现象是首先形成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色溶液;最终得到溶液中的含铜元素的离子是[Cu(NH3)4]2+(化学式),该离子含有的化学键类型有配位键、极性键.
(3)将硫酸铜晶体加热到1000℃以上生成的物质C,在C中的铜的离子的基态电子排布式是1s22s22p63s22p63d10;
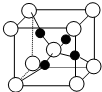
(4)如图是硫酸铜晶体分解得到一定温度的产物的晶胞(白球和黑球代表不同的原子).
①该温度是1000℃以上.
②铜原子的配位数是2.
③已知该晶体的密度为dg•cm-3,则晶胞参数是$\root{3}{\frac{288}{{N}_{A}d}}$×1010pm.
| A. | N2 | B. | BF3 | C. | PCl5 | D. | HCl |
| A. | 1mol醋酸的质量与NA个醋酸分子的质量相等 | |
| B. | NA个氧分子和NA个氢分子的质量比为16:1 | |
| C. | 28g氮气所含原子数目为NA | |
| D. | 在标准状况下,0.5NA个氯气分子所占的体积约是11.2L |


