题目内容
10.下列说法正确的是( )| A. | 标准状况下,2.24 L己烷含有分子的数目为0.1NA | |
| B. | 原子结构示意图: 表示12C,也可以表示13C 表示12C,也可以表示13C | |
| C. | 0.1 mol/L Na2S溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 由离子方程式□□+XO3-+6H+=3X2+3H2O可判断X元素的最高化合价为+5价 |
分析 A、标况下己烷为液态;
B、12C和13C的核外电子数和质子数相同;
C、根据质子守恒来分析;
D、根据离子方程式遵循原子守恒、电荷守恒和氧化还原反应遵循得失电子守恒来分析.
解答 解:A、标况下己烷为液态,故不能根据气体摩尔体积来计算其物质的量和含有的分子个数,故A错误;
B、12C和13C的核外电子数和质子数均相同,均为6个,故原子结构示意图相同,均为 ,故B正确;
,故B正确;
C、在 Na2S溶液中,所有的氢离子和氢氧根均来自于水的电离,而水电离出的氢离子和氢氧根的物质的量浓度相同,而水电离出的氢离子有部分被结合为HS-和H2S分子,故根据质子守恒有:c(OH-)=c(H+)+c(HS-)+2c(H2S),故C错误;
D、方程式右边电荷为0,根据离子方程式左右电荷相等,则方程式左边未知物应含有5个负电荷,根据方程式遵循质量守恒定律原子守恒可知,如生成3molX2,则XO3-为1mol,未知物为5mol,所以1mol未知物含有1mol负电荷,离子方程式为:5X-+XO3-+6H+═3X2+3H2O,X的最低化合价为-1价,则X原子核外最外层有7个电子,最高化合价为+7价,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
1.将H(CB11H6Cl6)与C60反应,C60得到一个质子,制得离子化合物[HC60]+[CB11H6Cl6]-.下列反应中,反应类型与之相似的是( )
| A. | Mg+2HCl→MgCl2+H2↑ | B. | NaOH+HCl→NaCl+H2O | ||
| C. | H2O+CH3COOH?H3O++CH3COO- | D. | NH3+HCl→NH4Cl |
18.下列化学反应的离子方程式正确的是( )
| A. | 用醋酸除去水垢:2CH3COOH+CO32-→2CH3COO-+H2O+CO2↑ | |
| B. | 硫酸铁溶液中通入硫化氢气体:2Fe3++3H2S→2FeS↓+S↓+6H+ | |
| C. | 铝与氢氧化钠溶液反应:Al+2OH-→AlO2-+H2↑ | |
| D. | 已知25℃时,电离常数Ki (苯甲酸)>Ki1(H2CO3)>Ki (苯酚)>Ki2(H2CO3).常温下将水杨酸(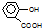 )与过量的Na2CO3溶液混合: )与过量的Na2CO3溶液混合: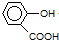 +2CO32-→ +2CO32-→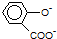 +2HCO3- +2HCO3- |
5.无铁硫酸铝是制造高档纸张和高级织物的重要原材料,制取无铁硫酸铝的工艺流程如图所示.铝土矿酸溶后得到含铁(Fe2+和Fe3+)的硫酸铝溶液,再经过后续加工,最终得到成品无铁硫酸铝(溶液中各种金属离子开始沉淀和沉淀完全时的pH见表).
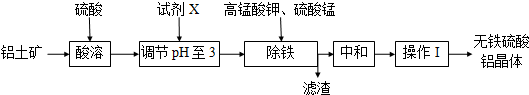
(1)试剂X可以用下列试剂中的a(填编号)
a.铝土矿粉 b.氢氧化钠 c.氧化钙
(2)生产中控制pH为3而不大于3的原因是pH超过3.3将导致Al3+沉淀,降低成品产量;
(3)操作I的名称蒸发浓缩、冷却结晶、过滤洗涤;
(4)除铁时,必须先加入高锰酸钾溶液,目的是把Fe2+转化为Fe3+;高锰酸钾溶液和硫酸锰溶液反应生成活性二氧化锰,写出反应的化学方程式2KMnO4+3MnSO4+2H2O═5MnO2↓+2H2SO4+K2SO4;
(5)滤渣的含铁成分是Fe(OH)3,用离子方程式表示其成因Fe3++3H2O?Fe(OH)3+3H+;
(6)活性二氧化锰能和Fe(OH)3发生吸附共沉作用,用化学平衡理论解释活性二氧化锰的作用吸附Fe(OH)3,促使Fe3+水解而充分沉淀(或促使水解平衡正向移动).

| 开始 | 完全 | |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.3 | 5.0 |
| Mn2+ | 8.3 | 9.8 |
a.铝土矿粉 b.氢氧化钠 c.氧化钙
(2)生产中控制pH为3而不大于3的原因是pH超过3.3将导致Al3+沉淀,降低成品产量;
(3)操作I的名称蒸发浓缩、冷却结晶、过滤洗涤;
(4)除铁时,必须先加入高锰酸钾溶液,目的是把Fe2+转化为Fe3+;高锰酸钾溶液和硫酸锰溶液反应生成活性二氧化锰,写出反应的化学方程式2KMnO4+3MnSO4+2H2O═5MnO2↓+2H2SO4+K2SO4;
(5)滤渣的含铁成分是Fe(OH)3,用离子方程式表示其成因Fe3++3H2O?Fe(OH)3+3H+;
(6)活性二氧化锰能和Fe(OH)3发生吸附共沉作用,用化学平衡理论解释活性二氧化锰的作用吸附Fe(OH)3,促使Fe3+水解而充分沉淀(或促使水解平衡正向移动).
2.分析如下残缺的反应:RO3-+□+6H+→3R2↑+3H2O.下列叙述正确的是( )
| A. | 上式中缺项所填物质在反应中作氧化剂 | |
| B. | 在RO3-参与的氧化还原反应中,R元素只能被还原 | |
| C. | 上述反应中,转移电子数为5NA | |
| D. | 同周期主族元素原子中R的原子半径最小 |
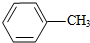 $\stackrel{MnO_{4}}{→}$
$\stackrel{MnO_{4}}{→}$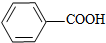
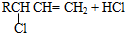 =CH2+HCl
=CH2+HCl
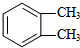 ,B苯环上的二氯代物的结构简式为:
,B苯环上的二氯代物的结构简式为: ,
, .
. .
.
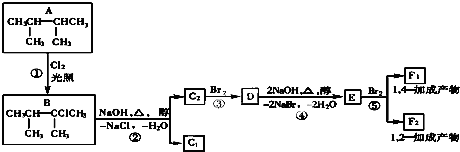
 .
. ,F1的结构简式是
,F1的结构简式是 .
.