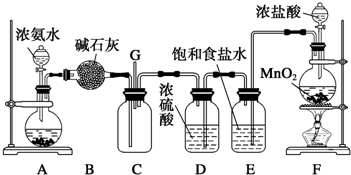
题目内容
5.链状有机物C4H6Cl2的同分异构体有17种(不考虑立体异构)分析 分子式为C4H6Cl2的链状有机物是4个碳的烯烃的二氯代物,先写出烯烃的同分异构体,然后采取“定一议二”法确定二氯代物.
解答 解:分子式为C4H6Cl2的链状有机物是4个碳的烯烃的二氯代物,先写出烯烃的同分异构体,然后采取“定一议二”法确定二氯代物,
C=C-C-C的二氯代物有8种;
C-C=C-C的二氯代物有6种;
CH2=C(CH3)2的二氯代物有3种;
综上所述,共17种同分异构体,
故答案为:17.
点评 本题考查学生有机物的同分异构体的书写知识,可以根据教材知识来回答,难度不大,注意解题方法的掌握可以节省解题时间.

练习册系列答案
相关题目
15.将三种黑色粉末组成的混和物加入到足量的某热浓酸中,充分反应后得到蓝绿色溶液和两种气体.将从蓝绿色溶液中分离得到的盐与0.15mol还原铁粉恰好反应完全,可得浅绿色溶液和6.4g红色沉淀;将上述生成的两种气体通入足量饱和NaHCO3溶液中,仍然收集到两种气体,据此推断黑色粉末可能为( )
| A. | 物质的量 FeS:CuO:Fe=1:1:1 | B. | 物质的量 C:CuO:Fe=3:2:2 | ||
| C. | 质量 MnO2:CuO:C=5.5:8:12 | D. | 质量 Fe:C:CuO=7:5:3 |
13.下列醇经催化氧化的产物是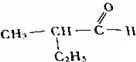 的是( )
的是( )
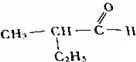 的是( )
的是( )| A. | 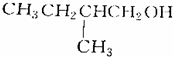 | B. | 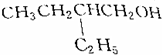 | ||
| C. |  | D. | 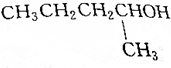 |
20.常温下,下列各组离子一定能在指定溶液由大量共存的是( )
| A. | 使甲基橙变红色的溶液中:Na+、Fe2+、MnO4-、AlO2- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | pH=0的溶液中:Al3+、Ag(NH3)2+、Cl-、SO42- | |
| D. | 加入Mg能放出H2的溶液中:Ca2+、NH4+、ClO-、NO3- |
10.下列图象中的曲线(纵坐标为沉淀或气体的量,横坐标为加入物质的量),其中错误的是( )
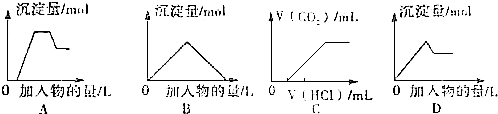

| A. | 图A表示想含OH-、AlO2-、CO32-、SiO32-、的溶液中滴加HCL溶液产生沉淀量的关系曲线 | |
| B. | 图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线 | |
| C. | 图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线 | |
| D. | 图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀量的关系曲线 |
7.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如表(KMnO4溶液已酸化),实验装置如图1:
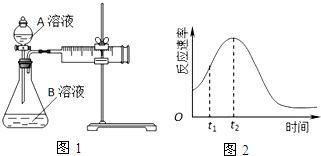
(1)该反应的离子方程为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.(已知H2C2O4是二元弱酸)
(2)该实验探究的是浓度因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是①<②(填实验序号).
(3)若实验①在2min末收集了2.24mL CO2(标准状况下),则在2min末,c(MnO4-)=0.0056mol•L-1.(假设混合溶液体积为50mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率.(一条即可)
(5)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:
①该反应放热;
②产物Mn2+是反应的催化剂.

| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol•L-1H2C2O4溶液 | 30mL 0.01mol•L-1KMnO4溶液 |
| ② | 20mL 0.2mol•L-1H2C2O4溶液 | 30mL 0.01mol•L-1KMnO4溶液 |
(2)该实验探究的是浓度因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是①<②(填实验序号).
(3)若实验①在2min末收集了2.24mL CO2(标准状况下),则在2min末,c(MnO4-)=0.0056mol•L-1.(假设混合溶液体积为50mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率.(一条即可)
(5)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:
①该反应放热;
②产物Mn2+是反应的催化剂.
4.草酸与高锰酸钾在酸性条件下能够发生如下反应:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
现用4mL 0.001mol/L KMnO4溶液与2mL 0.01mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
(1)该反应中还原剂是H2C2O4.(填化学式)
(2)对比实验I和II(用Ⅰ~Ⅳ表示,下同),可以研究催化剂对化学反应速率的影响;如果研究温度对化学反应速率的影响,对比实验I和III.
(3)对比实验Ⅰ和Ⅳ,可以研究硫酸的浓度(或氢离子的浓度)对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保对比实验中c(KMnO4)、c(H2C2O4)相同(溶液总体积相同).
现用4mL 0.001mol/L KMnO4溶液与2mL 0.01mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
(2)对比实验I和II(用Ⅰ~Ⅳ表示,下同),可以研究催化剂对化学反应速率的影响;如果研究温度对化学反应速率的影响,对比实验I和III.
(3)对比实验Ⅰ和Ⅳ,可以研究硫酸的浓度(或氢离子的浓度)对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保对比实验中c(KMnO4)、c(H2C2O4)相同(溶液总体积相同).
5.常温下,不能与Al单质发生反应的是( )
| A. | CuSO4溶液 | B. | Fe2O3 | C. | 浓硫酸 | D. | NaOH溶液 |