题目内容
 Na、Cu、Al、O、C、H是常见的六种元素.
Na、Cu、Al、O、C、H是常见的六种元素.(1)Al位于元素周期表第
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 沸点 |
| Na | O2- | CH4 |
| 物 质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
②已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ?mol-1
CO(g)+H2O (g)═CO2(g)+H2 (g)△H=+2.8kJ?mol-1
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ?mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g) 的△H=
(4)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
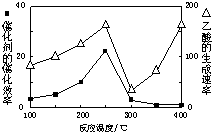
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是
②为了提高该反应中CH4的转化率,可以采取的措施是
考点:化学平衡的计算,原子核外电子排布,元素电离能、电负性的含义及应用,用盖斯定律进行有关反应热的计算,化学平衡的影响因素
专题:化学反应中的能量变化,元素周期律与元素周期表专题,化学平衡专题
分析:(1)Al为13号元素,位置第三周期、第IIIA主族;Cu是29号元素,原子核外电子数为29,根据核外电子排布规律书写铜的基态原子价电子电子排布式;
(2)金属性越强,第一电离能越小;核外电子排布相同的离子,原子序数越大,半径越小;含有氢键的氢化物沸点较高;
(3)①先利用三段法求出各物质的物质的量,然后再根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;
②根据盖斯定律来解答;
(4)①根据温度对催化剂活性的影响分析;
②提高该反应中CH4的转化率平衡正向移动,反应物转化率增大,根据外界条件对化学平衡的影响分析.
(2)金属性越强,第一电离能越小;核外电子排布相同的离子,原子序数越大,半径越小;含有氢键的氢化物沸点较高;
(3)①先利用三段法求出各物质的物质的量,然后再根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;
②根据盖斯定律来解答;
(4)①根据温度对催化剂活性的影响分析;
②提高该反应中CH4的转化率平衡正向移动,反应物转化率增大,根据外界条件对化学平衡的影响分析.
解答:
解:(1)Al为13号元素,位置第三周期、第IIIA主族;Cu是29号元素,原子核外电子数为29,铜的基态原子价电子电子排布式3d104s1,
故答案为:三、IIIA;3d104s1;
(2)金属性越强,越容易失去一个电子,则第一电离能越小,所以第一电离能:Na<Al;核外电子排布相同的离子,原子序数越大,半径越小,则离子半径:O2->Na+;含有氢键的氢化物沸点较高,水分子之间存在氢键沸点比甲烷的高;
故答案为:<、>、<;
(3)①CO2(g)+CH4(g)?2CO(g)+2H2(g).
起始(mol) 6 6 0 0
反应(mol) x x 2x 2x
平衡(mol) 6-x 6-x 2x 2x
由CH4的体积分数为0.1,则
=0.1,解得x=4,所以K=
=
=64,
故答案为:64;
②CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1 ①
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=2.8kJ?mol-1 ②
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ?mol-1 ③
根据盖斯定律,由①+②×2-③×2得,CO2(g)+CH4(g)?2CO(g)+2H2(g)△H=-890.3kJ?mol-1+2.8kJ?mol-1×2+566.0kJ?mol-1×2=+247.3 kJ?mol-1,
故答案为:+247.3 kJ?mol-1;
(4)①温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,故答案:温度超过250℃时,催化剂的催化效率降低;
②增大反应压强、增大CO2的浓度,平衡正向移动,反应物转化率增大,故答案为:增大反应压强、增大CO2的浓度;
故答案为:三、IIIA;3d104s1;
(2)金属性越强,越容易失去一个电子,则第一电离能越小,所以第一电离能:Na<Al;核外电子排布相同的离子,原子序数越大,半径越小,则离子半径:O2->Na+;含有氢键的氢化物沸点较高,水分子之间存在氢键沸点比甲烷的高;
故答案为:<、>、<;
(3)①CO2(g)+CH4(g)?2CO(g)+2H2(g).
起始(mol) 6 6 0 0
反应(mol) x x 2x 2x
平衡(mol) 6-x 6-x 2x 2x
由CH4的体积分数为0.1,则
| 6-x |
| 12+2x |
| c2(CO)?c2(H2) |
| c(CO2)?c(CH4) |
| 22×22 |
| 0.5×0.5 |
故答案为:64;
②CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1 ①
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=2.8kJ?mol-1 ②
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ?mol-1 ③
根据盖斯定律,由①+②×2-③×2得,CO2(g)+CH4(g)?2CO(g)+2H2(g)△H=-890.3kJ?mol-1+2.8kJ?mol-1×2+566.0kJ?mol-1×2=+247.3 kJ?mol-1,
故答案为:+247.3 kJ?mol-1;
(4)①温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,故答案:温度超过250℃时,催化剂的催化效率降低;
②增大反应压强、增大CO2的浓度,平衡正向移动,反应物转化率增大,故答案为:增大反应压强、增大CO2的浓度;
点评:本题考查了电子排布式、元素周期律、化学平衡常数的计算、化学平衡的移动、盖斯定律的应用等,题目涉及的知识点较多,侧重于基础知识的综合应用的考查,题目难度中等.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
分子式为C5H11Cl的卤代烃,其分子中含有两个-CH3,两个-CH2-,一个
-和一个-Cl,他可能的结构有( )
| CH |
| | |
| A、2种 | B、3种 | C、4种 | D、5种 |
下列有关物质的应用不正确的是( )
| A、碳酸氢钠具有弱碱性,可治疗胃酸过多 |
| B、氧化镁熔点高,可做耐高温材料 |
| C、二氧化硫具有漂白性,可用于漂白纸浆和草帽辫 |
| D、二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |
将物质的量之比为1:1的Na2CO3与NaHCO3溶于水配成等体积的溶液,则所得溶液中的钠离子的物质的量之比为 ;若将两种溶液分别与同浓度的盐酸完全反应,消耗盐酸的体积比为 ,放出CO2的体积比为 .
迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述正确的是( ) 

| A、迷迭香酸属于芳香烃 |
| B、1mol迷迭香酸最多能和8mol氢气发生加成反应 |
| C、迷迭香酸可以发生水解反应、取代反应和酯化反应 |
| D、1mol迷迭香酸与NaOH的水溶液完全反应时最多消耗5molNaOH |
下列反应不属于取代反应的是( )
| A、由乙醇制乙醚 |
| B、甘氨酸分子间脱水制二肽 |
| C、由丙酮制2-丙醇 |
| D、苯甲酸乙酯水解制苯甲酸和乙醇 |
下列关于金属元素特征的叙述正确的是( )
| A、金属元素的原子只有还原性,离子只有氧化性 |
| B、金属单质在常温下均是固体 |
| C、金属元素能存在于阳离子中,而不能存在于阴离子中 |
| D、金属元素在化合物中一定显正价 |

 X、Y、Z、W四种常见元素,且均为短周期元素.已知:①X的最高价氧化物对应的水化物为无机酸中最强酸;②Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料;③Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料;④W被称为军事金属,可在CO2中燃烧.
X、Y、Z、W四种常见元素,且均为短周期元素.已知:①X的最高价氧化物对应的水化物为无机酸中最强酸;②Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料;③Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料;④W被称为军事金属,可在CO2中燃烧.