题目内容
1.下列实验室制气体的措施或方法中主要利用的是原电池反应原理的是( )| A. | 实验室制H2时,向Zn和稀硫酸反应体系中加入少量的CuSO4固体 | |
| B. | 实验室制O2时,向H2O2溶液中加入少量的MnO2 | |
| C. | 实验室制CO2时,用盐酸和CaCO3反应 | |
| D. | 实验室制NH3时,加热Ca(OH)2和NH4Cl和混合物 |
分析 A、锌和硫酸的反应中加入少量的CuSO4溶液,能置换出一定量Cu,在溶液中形成Cu/Zn原电池,原电池反应比化学反应速率快;
B、二氧化锰是催化剂,加快化学反应的速率;
C、实验室制取二氧化碳是利用强酸制弱酸;
D、实验室制NH3时,加热Ca(OH)2和NH4Cl和混合物制得氨气是利用利复分解反应制得弱电解质一水合氨,然后根据一水合氨不稳定受热分解.
解答 解:A、锌和硫酸的反应中加入少量的CuSO4溶液,能置换出一定量Cu,在溶液中形成Cu/Zn原电池,原电池反应比化学反应速率快,是利用原电池反应原理,故A正确;
B、二氧化锰是催化剂,加快化学反应的速率,与原电池原理无关,故B错误;
C、实验室制CO2时,用盐酸和CaCO3反应,是利用强酸制弱酸,与原电池原理无关,故C错误;
D、实验室制NH3时,加热Ca(OH)2和NH4Cl和混合物制得氨气是利用利复分解反应制得弱电解质一水合氨,然后根据一水合氨不稳定受热分解,与原电池原理无关,故D错误;
故选A.
点评 本题主要考查影响化学反应速率的因素,原电池原理能够加快反应速率.侧重考查考生运用所学知识灵活作答的思维能力,题目难度不大.

练习册系列答案
相关题目
16.下列说法中正确的是( )
| A. | 干冰与二氧化硅晶体熔化时,所克服的微粒间相互作用相同 | |
| B. | 晶体的熔点由高到低排列顺序为SiO2、CsCl、CBr4、CF4 | |
| C. | 1molNaCl中有NA个NaCl分子 | |
| D. | 任何晶体中,若含有阳离子就一定含有阴离 |
17.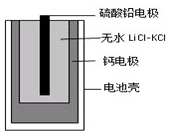 热激活电池可用作火箭、导弹的工作电池.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池的总反应方程式为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb.
热激活电池可用作火箭、导弹的工作电池.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池的总反应方程式为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb.
下列有关说法正确的是( )
 热激活电池可用作火箭、导弹的工作电池.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池的总反应方程式为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb.
热激活电池可用作火箭、导弹的工作电池.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池的总反应方程式为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb.下列有关说法正确的是( )
| A. | 正极反应式:Ca+2Cl--2e-=CaCl2 | |
| B. | 放电过程中,Li+向钙电极移动 | |
| C. | 外电路中,电子由硫酸铅电极经导线流向钙电极 | |
| D. | 常温时,在正负极间接上电流表或检流计,指针不偏转 |
14.以下转化不能通过置换反应实现的是( )
| A. | Na→H2 | B. | Cu→CuCl2 | C. | Cl2→NaCl | D. | CuO→Cu |
1.分类方法在化学学科的发展中起到了非常重要的作用.下列分类标准合理的是( )
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学反应分为放热反应和吸热反应.
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学反应分为放热反应和吸热反应.
| A. | ①③ | B. | ②④ | C. | ①②④ | D. | ②③④ |
6.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 12g石墨烯(单层石墨)中含C原子个数为NA | |
| B. | 等质量的C18O与NO含有的原子个数均为2NA | |
| C. | 1.0L 1.0mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| D. | 25℃时1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA |
10.下列有关气体摩尔体积的描述正确的是( )
| A. | 通常状况下的气体摩尔体积约为22.4L | |
| B. | 标准状况下的气体摩尔体积约为22.4L | |
| C. | 相同物质的量的气体气体摩尔体积相同 | |
| D. | 同温同压的气体气体摩尔体积相同 |
11.下列实验事实和对实验事实的理论解释都正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | H2S的沸点比H2O的高 | H2S的范德华力大于H2O的范德华力 |
| B | 第一电离能Mg>Al | Mg的3P轨道处于全空状态,能量低,越稳定 |
| C | 熔点Na<Al | 同为金属晶体,Al原子半径小,外围电子多,晶格能大 |
| D | 键的极性:H-O>N-H | 非金属性差异越大,键的极性越小 |
| A. | A | B. | B | C. | C | D. | D |