题目内容
 肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均生成氮气和水,可作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均生成氮气和水,可作火箭燃料.(1肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.该电池放电时,负极的电极反应式是
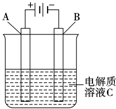
(2)如图是一个电化学装置示意图.用肼-空气燃料电池作此装置的电源.A是铂电极,B是石墨电极,C是稀硫酸,阴极的电极反应式是
考点:化学电源新型电池
专题:电化学专题
分析:(1)从作为燃料电池时,负极发生氧化反应的角度可知N2H4被氧化生成N2;电池的总反应式即N2H4与氧气反应生成氮气和水;
(2)石墨电极与负极相连为阴极,阴极上氢离子得电子;根据串联电路中电子守恒计算.
(2)石墨电极与负极相连为阴极,阴极上氢离子得电子;根据串联电路中电子守恒计算.
解答:
解:(1)作为燃料电池时,负极发生氧化反应,电解质溶液是20%-30%的KOH溶液,N2H4失去电子被氧化生成N2,其电极反应为:N2H4+4OH--4e-=N2+4H2O;电池的总反应式即N2H4与氧气反应生成氮气和水,其电池的总反应式为:N2H4+2H2O=N2+2H2O;
故答案为:N2H4+4OH--4e-=N2+4H2O;N2H4+2H2O=N2+2H2O;
(2)石墨电极与负极相连为阴极,阴极上氢离子得电子,其电极方程式为:2H++2e-=H2↑;
H2O2 ~S2O82-~2SO42-~2e-~
N2H4
1mol 0.5mol
则要制取1mol H2O2,该燃料电池理论上需消耗0.5molN2H4;
故答案为:2H++2e-=H2↑;0.5.
故答案为:N2H4+4OH--4e-=N2+4H2O;N2H4+2H2O=N2+2H2O;
(2)石墨电极与负极相连为阴极,阴极上氢离子得电子,其电极方程式为:2H++2e-=H2↑;
H2O2 ~S2O82-~2SO42-~2e-~
| 1 |
| 2 |
1mol 0.5mol
则要制取1mol H2O2,该燃料电池理论上需消耗0.5molN2H4;
故答案为:2H++2e-=H2↑;0.5.
点评:本题考查原电池和电解池的工作原理,做题时注意两极上的变化,要会书写电极反应式,从质量守恒和电子守恒的角度做题,题目难度中等.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
要除去下列四种物质中的少量杂质(括号内的物质为杂质):甲:CaCO3(Na2CO3);乙:NaOH(Na2CO3);丙:KCl(KHCO3);丁:碳粉(CuO)可选用的试剂及操作方法有:①加适量盐酸,搅拌,过滤;②加适量水,搅拌,过滤;③加适量盐酸,蒸发;④溶解,加适量石灰水,过滤,蒸发.下列组合正确的是( )
| A、甲-②,乙-④ |
| B、乙-③,丙-① |
| C、丙-①,丁-② |
| D、丁-②,丙-③ |
用NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
| A、7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
| B、含2mol H2SO4的浓硫酸与足量金属铜完全反应,产生SO2的数目为NA |
| C、常温下,1.0L 1.0mol?L-1 NaAlO2溶液中含有的氧原子数为2NA |
| D、0.1mol Fe参加氧化还原反应,转移的电子数目一定是0.2NA |
 为研究HA、HB溶液和MOH的酸碱性的相对强弱,某化学学习小组设计了以下实验:室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图所示,根据所给数据,请回答下列问题:
为研究HA、HB溶液和MOH的酸碱性的相对强弱,某化学学习小组设计了以下实验:室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图所示,根据所给数据,请回答下列问题: