题目内容
某校化学研究性学习小组在学习了金属的知识后,探究Cu的常见化合物的性质.过程如下:
【提出问题】
①在元素周期表中,Cu、Al位置接近,Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,Fe2+的稳定性小于Fe3+的,Cu+的稳定性也小于Cu2+的吗?
③CuO有氧化性,能被H2、CO等还原,也能被NH3还原吗?
【实验方案】
(1)解决问题①需用到的药品有CuSO4溶液、 (填试剂名称,一种或多种),同时进行相关实验.
(2)解决问题②的实验步骤和现象如下:取98g Cu(OH)2固体,加热至80~100℃时,得到80g黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A.冷却后称量,A的质量为72g,A的化学式为 .向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在,则反应的离子方程式为 .
(3)为解决问题③,设计的实验装置如图所示(夹持及尾气处理装置未画出):实验中观察到CuO变为红色物质.查资料可知,同时生成一种无污染的气体,该气体的化学式为 .
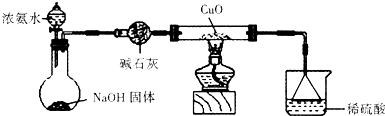
【实验结论】
(4)Cu(OH)2具有两性.证明Cu(OH)2具有两性的实验现象是 .
(5)根据实验方案(2),得出的Cu+和Cu2+稳定性大小的结论:高温时 ;在酸性溶液中 .
(6)Cu0能被NH3还原.
有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物.请你设计一个简单的实验方案验证NH3与CuO反应后生成的红色物质中是否含有A: .
【提出问题】
①在元素周期表中,Cu、Al位置接近,Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,Fe2+的稳定性小于Fe3+的,Cu+的稳定性也小于Cu2+的吗?
③CuO有氧化性,能被H2、CO等还原,也能被NH3还原吗?
【实验方案】
(1)解决问题①需用到的药品有CuSO4溶液、
(2)解决问题②的实验步骤和现象如下:取98g Cu(OH)2固体,加热至80~100℃时,得到80g黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A.冷却后称量,A的质量为72g,A的化学式为
(3)为解决问题③,设计的实验装置如图所示(夹持及尾气处理装置未画出):实验中观察到CuO变为红色物质.查资料可知,同时生成一种无污染的气体,该气体的化学式为

【实验结论】
(4)Cu(OH)2具有两性.证明Cu(OH)2具有两性的实验现象是
(5)根据实验方案(2),得出的Cu+和Cu2+稳定性大小的结论:高温时
(6)Cu0能被NH3还原.
有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物.请你设计一个简单的实验方案验证NH3与CuO反应后生成的红色物质中是否含有A:
考点:性质实验方案的设计
专题:实验设计题
分析:【实验方案】
(1)要证明Cu(OH)2具有两性,应先加入碱生成Cu(OH)2,根据提供的药品可确定还需要的药品;
(2)根据质量守恒计算中含有1molCu,质量为64g,剩余为O元素;依据反应现象书写离子方程式;
(3)根据反应遵循质量守恒定律和该气体物污染确定气体的化学式;
【实验结论】
(4)根据两性氢氧化物的性质来分析,如具有两性,Cu(OH)2既能溶解于强酸,又能溶解于强碱;
(5)根据在不同温度下反应物的组成可确定物质的稳定性;
【问题讨论】
(6)A为Cu2O,在酸性条件下不稳定,可加入酸进行检验.
(1)要证明Cu(OH)2具有两性,应先加入碱生成Cu(OH)2,根据提供的药品可确定还需要的药品;
(2)根据质量守恒计算中含有1molCu,质量为64g,剩余为O元素;依据反应现象书写离子方程式;
(3)根据反应遵循质量守恒定律和该气体物污染确定气体的化学式;
【实验结论】
(4)根据两性氢氧化物的性质来分析,如具有两性,Cu(OH)2既能溶解于强酸,又能溶解于强碱;
(5)根据在不同温度下反应物的组成可确定物质的稳定性;
【问题讨论】
(6)A为Cu2O,在酸性条件下不稳定,可加入酸进行检验.
解答:
解:【实验方案】(1)Cu不如Al活泼,可以用硫酸溶液进行验证,要证明Cu(OH)2具有两性,应先加入碱生成Cu(OH)2,药品中缺少氢氧化钠溶液,故答案为:稀硫酸、氢氧化钠溶液;
(2)98g Cu(OH)2固体的物质的量为1mol,解热分解生成的72g固体中含有Cu的质量为1mol,即64g,则氧原子的质量为72g-64g8g,n(O)=
=0.5mol,
则A中n(Cu):n(O)=2:1,向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在,说明生成了铜和铜离子,反应的离子方程式为:Cu2O+2H+=Cu+Cu2++H2O,故答案为:Cu2O;Cu2O+2H+=Cu+Cu2++H2O;
(3)氧化铜和氨气反应生成红色物质铜,根据反应遵循质量守恒定律和该气体无污染确定气体为氮气,故答案为:N2;
【实验结论】
(4)如具有两性,Cu(OH)2既能溶解于强酸,又能溶解于强碱,分别生成盐和水,故答案为:Cu(OH)2既能溶解于强酸,又能溶解于强碱;
(5)80℃~100℃时,得到黑色固体粉末,为CuO,继续加热到1000℃以上,黑色粉末全部变成红色粉末,说明在较高温度时Cu2O稳定,与酸反应生成硫酸铜和铜,说明在酸性条件下+2价的铜稳定,故答案为:Cu+稳定性大于Cu2+;Cu2+稳定性大于Cu+;
【问题讨论】
(6)如含有Cu2O,根据其与酸反应的现象可判断,方程式为:Cu2O+H2SO4═Cu+CuSO4+H2O,溶液变蓝,而铜与稀硫酸不反应,
故答案为:取样,加入稀硫酸,如果得到蓝色溶液和红色固体,说明有A; 如果不溶解,说明无A;
(2)98g Cu(OH)2固体的物质的量为1mol,解热分解生成的72g固体中含有Cu的质量为1mol,即64g,则氧原子的质量为72g-64g8g,n(O)=
| 8g |
| 16g/mol |
则A中n(Cu):n(O)=2:1,向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在,说明生成了铜和铜离子,反应的离子方程式为:Cu2O+2H+=Cu+Cu2++H2O,故答案为:Cu2O;Cu2O+2H+=Cu+Cu2++H2O;
(3)氧化铜和氨气反应生成红色物质铜,根据反应遵循质量守恒定律和该气体无污染确定气体为氮气,故答案为:N2;
【实验结论】
(4)如具有两性,Cu(OH)2既能溶解于强酸,又能溶解于强碱,分别生成盐和水,故答案为:Cu(OH)2既能溶解于强酸,又能溶解于强碱;
(5)80℃~100℃时,得到黑色固体粉末,为CuO,继续加热到1000℃以上,黑色粉末全部变成红色粉末,说明在较高温度时Cu2O稳定,与酸反应生成硫酸铜和铜,说明在酸性条件下+2价的铜稳定,故答案为:Cu+稳定性大于Cu2+;Cu2+稳定性大于Cu+;
【问题讨论】
(6)如含有Cu2O,根据其与酸反应的现象可判断,方程式为:Cu2O+H2SO4═Cu+CuSO4+H2O,溶液变蓝,而铜与稀硫酸不反应,
故答案为:取样,加入稀硫酸,如果得到蓝色溶液和红色固体,说明有A; 如果不溶解,说明无A;
点评:本题考查实验探究和数据处理,做题时注意两性氢氧化物的性质以及质量守恒定律计算物质的化学式.本题有一定难度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,要使溶液中
值增大,可以采取的措施是( )
| c(H+) |
| c(CH3COOH) |
| A、加大量稀的食盐溶液 |
| B、降低温度 |
| C、加少量冰醋酸 |
| D、加少量烧碱溶液 |
1mol甲醛和氢气组成的混合物质量为16g,完全燃烧后的产物通过足量的Na2O2,Na2O2增加的质量为( )
| A、8g | B、16g |
| C、20g | D、40g |
用NA表示阿伏加德罗常数的值.下列叙述错误的是( )
| A、常温常压下,22.4L氮气含有的氮原子数小于2NA | ||
| B、15g甲基(-CH3)所含的电子数为7NA | ||
C、标准状况下,密度为dg/L的某气体纯净一个分子的质量为
| ||
| D、4.6gNa在氧气中完全反应生成Na2O和Na2O2,生成物中阴离子个数为0.1NA |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、将NA个HCl分子溶于500mL水中得到2.0mol/L的盐酸 |
| B、在加热条件下,100mL 18.4mol/L的浓硫酸与足量金属铜反应得到的SO2的分子数为0.92NA |
| C、密闭容器中,1molSO2与0.5 molO2充分反应,转移的电子数小于2NA |
| D、用惰性电极电解AgNO3溶液,产生11.2LO2时,转移2mol电子 |
下列离子方程式不正确的是( )
A、向硝酸亚铁溶液中滴加少量盐酸:3Fe2++N
| |||||||||||||||||
B、将石灰乳与饱和碳酸钠溶液混合:Ca2++C
| |||||||||||||||||
C、向30mL 1mol?L-1的Na2S
| |||||||||||||||||
D、实验室制氢氧化铁胶体:Fe3++3H2O
|
下列化学用语或说法正确的是( )
| A、次氯酸的结构式:H-Cl-O |
| B、CCl4、CS2、NCl3中所有原子都满足最外层为8个电子的稳定结构 |
C、对硝基苯酚的结构简式为 |
D、聚丙烯的结构简式为 |
 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件均未列出).
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件均未列出).