题目内容
10.ClO2是一种杀菌消每效率高、二次污染小的水处理剂.实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O.下列有关该反应的说法正确的是( )| A. | H2C2O4是氧化剂 | B. | KClO3是还原剂 | ||
| C. | H2C2O4被氧化 | D. | H2SO4发生氧化反应 |
分析 2KClO3+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O中Cl元素的化合价降低,C元素的化合价升高,以此来解答.
解答 解:A.C元素失去电子,则草酸为还原剂,故A错误;
B.Cl元素得到电子,氯酸钾为氧化剂,故B错误;
C.C失去电子,草酸被氧化,故C正确;
D.硫酸为反应物,只体现酸性,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意基本概念的应用,题目难度不大.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
20.酚酞是一种常用的酸碱指示剂,其结构简式如图所示,酚酞属于( )


| A. | 氧化物 | B. | 碱 | C. | 有机物 | D. | 无机物 |
1. 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).
实验测得不同温度下的平衡数据列于表:
①可以判断该分解反应已经达到平衡的是BC.(填编号)
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:K=1.6×10-8mol3/L3.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加 (填“增加”,“减少”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填“>”、“=”或“<”),熵变△S>0(填“>”、“=”或“<”).
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示.
计算25.0℃时,0~6min 氨基甲酸铵水解反应的平均速率0.05mol/(L•min).
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).
实验测得不同温度下的平衡数据列于表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总液度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:K=1.6×10-8mol3/L3.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加 (填“增加”,“减少”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填“>”、“=”或“<”),熵变△S>0(填“>”、“=”或“<”).
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示.
计算25.0℃时,0~6min 氨基甲酸铵水解反应的平均速率0.05mol/(L•min).
5.下列由实验现象得出的结论正确的是( )
| 操作及现象 | 结论 | |
| A | 向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4和KMnO4溶液,观察气体产生的速度 | 比较CuSO4和KMnO4的催化效果 |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色. | 溶液中一定含有Fe2+ |
| C | 测定等浓度的HCOOK和K2S溶液的pH | 比较Ka(HCOOH) 和Ka2(H2S)的大小 |
| D | C2H5OH与浓硫酸混合后加热到170°C,制得的气体使酸性KMnO4溶液褪色 | 一定是制得的乙烯使酸性KMnO4溶液褪色 |
| A. | A | B. | B | C. | C | D. | D |
2.下列以高粱为主要原料的酿醋工艺中,利用醋酸溶解性的是( )
| A. |  蒸拌原料 蒸拌原料 | B. |  淀粉发酵 淀粉发酵 | C. |  用水浸淋 | D. |  放置陈酿 放置陈酿 |
19.下列过程中肯定没有发生化学变化的是( )
| A. | 用糯米酿制甜酒 | |
| B. | 石油气的液化与煤的液化 | |
| C. | 书籍中的纸张由白色慢慢变成黄色 | |
| D. | 含有吸水性的植物纤维的干燥剂吸水胀包 |

 .
.
 ;
; ;
; .
. .
. .
. 和
和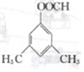 .
. . 仿照上述流程,设计以苯、乙醛为有机原料(无机试剂任选)制备某药物中间体
. 仿照上述流程,设计以苯、乙醛为有机原料(无机试剂任选)制备某药物中间体 的合成路线:
的合成路线: .
.