题目内容
15.如图为一些物质之间的转化关系,其中部分反应中反应物或生成物未列全.已知A、H、I、K均为家庭厨房中的常见物质,其中A是食品调味剂,H是消毒剂的有效成分,I、K可用作食品发泡剂.B是一种有机酸盐,E、F、G均为氧化物,L是红褐色沉淀.
根据以上信息,回答下列问题:
(1)H的化学式为NaClO.
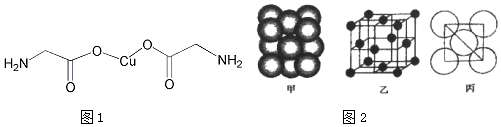
(2)A的电子式
 .
.(3)G→J的离子方程式为2FeO+H2O2+6H+=2Fe3++4H2O.
(4)M是含氧酸盐,化学式为Na2FeO4,则反应①的化学方程式为3NaClO+2Fe(OH)3+4NaOH=2Na2FeO4+3NaCl+5H2O.
分析 A是食品调味剂,水溶液的电解产物反应生成的H是消毒剂的有效成分,则A为NaCl,H为NaClO,G为氧化物,加H2SO4、H2O2生成J,J加D得L,L为红褐色沉淀,则L为Fe(OH)3,D为NaOH,以此逆推可知J为Fe2(SO4)3,G为FeO,则B中含有Fe元素,C为Cl2,B为有机酸盐,则一定含有C、O两元素,E、F为氧化物,结合框图,则F为CO,E为CO2,I为Na2CO3(纯碱),K为NaHCO3(小苏打),均可作食品的发泡剂,结合对应物质的性质以及题目要求解答该题.
解答 解:(1)H的化学式为NaClO,故答案为:NaClO;
(2)A为NaCl,为离子化合物,其电子式为 ,故答案为:
,故答案为: ;
;
(3)G→J的离子方程式为2FeO+H2O2+6H+=2Fe3++4H2O,故答案为:2FeO+H2O2+6H+=2Fe3++4H2O;
(4)M是含氧酸盐,化学式为Na2FeO4,Fe元素的化合价升高,Cl元素的化合价降低,由电子、原子守恒可知反应①的化学方程式为3NaClO+2Fe(OH)3+4NaOH=2Na2FeO4+3NaCl+5H2O,
故答案为:3NaClO+2Fe(OH)3+4NaOH=2Na2FeO4+3NaCl+5H2O.
点评 本题考查无机物的推断,为高频考点,把握图中转化关系、物质的性质及生活中的应用、红褐色沉淀为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
5.下列过程中,需要吸收能量的是( )
| A. | 水蒸气通过炽热的焦炭制取水煤气 | B. | 盐酸与氢氧化钠溶液发生中和反应 | ||
| C. | 氢氧化钠固体溶于水 | D. | 钠在空气中燃烧 |
3.化学与生活密切相关,下列说法错误的是( )
| A. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| B. | 海轮船体镶嵌锌块是牺牲阳极的阴极保护法,防止船体被腐蚀 | |
| C. | 氢氧化铝和碳酸钠均可用于治疗胃酸过多 | |
| D. | 食用油反复加热会产生稠环芳烃等有害物质 |
10.ClO2是一种杀菌消每效率高、二次污染小的水处理剂.实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O.下列有关该反应的说法正确的是( )
| A. | H2C2O4是氧化剂 | B. | KClO3是还原剂 | ||
| C. | H2C2O4被氧化 | D. | H2SO4发生氧化反应 |
20. A、B、C是原子序数依次增大的短周期主族元素,三种元素原子序数之和为35,且C的原子序数是A的2倍.A、B、C三种元素的单质在适当条件下可发生如图所示的变化.下列说法不正确的是( )
A、B、C是原子序数依次增大的短周期主族元素,三种元素原子序数之和为35,且C的原子序数是A的2倍.A、B、C三种元素的单质在适当条件下可发生如图所示的变化.下列说法不正确的是( )
 A、B、C是原子序数依次增大的短周期主族元素,三种元素原子序数之和为35,且C的原子序数是A的2倍.A、B、C三种元素的单质在适当条件下可发生如图所示的变化.下列说法不正确的是( )
A、B、C是原子序数依次增大的短周期主族元素,三种元素原子序数之和为35,且C的原子序数是A的2倍.A、B、C三种元素的单质在适当条件下可发生如图所示的变化.下列说法不正确的是( )| A. | 甲、乙、丙三种物质的水溶液均显碱性 | |
| B. | 单质A、C均存在同素异形体 | |
| C. | 甲、乙可能都其有漂白性 | |
| D. | 丙的水溶液在空气中长期放置,溶液可能会变浑浊 |
4.杀鼠灵是一种抗凝血性杀毒剂,其结构简式如图,下列说法正确的是( )


| A. | 分子中有1个手性碳原子 | B. | 遇FeCl3溶液显紫色 | ||
| C. | 1mol杀鼠灵最多能与9molH2反应 | D. | 能萃取碘水中的碘单质 |




 .
. .
. .
. .
.