题目内容
18.铜屑放入稀硫酸不发生反应,若在稀硫酸中加入H2O2,铜屑可逐渐溶解,该反应的离子方程式是Cu+H2O2+2H+=Cu2++2H2O.分析 由信息可知,Cu与H2O2在酸性条件下发生氧化还原反应,Cu失去电子,O得到电子,以此来解答.
解答 解:由信息可知,Cu与H2O2在酸性条件下发生氧化还原反应,Cu失去电子,O得到电子,由电子、电荷守恒可知离子反应为Cu+H2O2+2H+=Cu2++2H2O,
故答案为:Cu+H2O2+2H+=Cu2++2H2O.
点评 本题考查离子反应方程式的书写,为高频考点,把握习题中的信息、氧化还原反应的应用为解答的关键,侧重分析与应用能力的考查,注意元素的化合价变化及电子守恒,题目难度不大.

练习册系列答案
相关题目
8. 如图是一套实验制取气体的装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是
如图是一套实验制取气体的装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是
( )
 如图是一套实验制取气体的装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是
如图是一套实验制取气体的装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是 ( )
| A. | 铜屑和稀硝酸 | B. | 碳酸钙和稀盐酸 | ||
| C. | 二氧化锰和浓盐酸 | D. | 氧化钙和浓氨水 |
9.NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | l8gNH4+中所含的电子数为11NA | |
| B. | 常温下,1L PH=1的H2SO4溶液中含有的H+的数目为0.2NA | |
| C. | 标准状况下,22.4LCl2完全溶于水时形成氯水时,转移电子数为NA | |
| D. | 常温常压下,3.4gH2O2含有极性键的数目为0.2NA |
3.化学与生活密切相关,下列说法错误的是( )
| A. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| B. | 海轮船体镶嵌锌块是牺牲阳极的阴极保护法,防止船体被腐蚀 | |
| C. | 氢氧化铝和碳酸钠均可用于治疗胃酸过多 | |
| D. | 食用油反复加热会产生稠环芳烃等有害物质 |
10.ClO2是一种杀菌消每效率高、二次污染小的水处理剂.实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O.下列有关该反应的说法正确的是( )
| A. | H2C2O4是氧化剂 | B. | KClO3是还原剂 | ||
| C. | H2C2O4被氧化 | D. | H2SO4发生氧化反应 |


 $\stackrel{-H_{2}O}{→}$(CH3)3CCHO=CHCHO
$\stackrel{-H_{2}O}{→}$(CH3)3CCHO=CHCHO .
. .
. .
.


 .
. .
. .
. .
.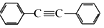 以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如图:
以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如图:
 ,B的官能团名称为羰基.
,B的官能团名称为羰基. .
. .
. 或
或 .
. 的合成路线:
的合成路线: .
.