题目内容
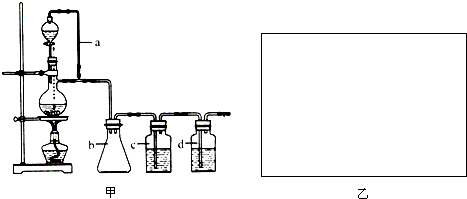
某研究性学习小组为设计出原料气的制备装置(如图甲).
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸,从中选择合适的试剂制备氢气,写出化学反应方程式: .
(2)CO的制备原理:HCOOH
CO↑+H2O,若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是 , .c和d中盛装的试剂分别是 , .若用以上装置制备H2,在图乙方框内画出收集干燥H2的装置图.

请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸,从中选择合适的试剂制备氢气,写出化学反应方程式:
(2)CO的制备原理:HCOOH
| 浓H2SO4 |
| △ |
考点:常见气体制备原理及装置选择
专题:实验题
分析:(1)稀硝酸、浓硫酸具有强氧化性,因此制备氢气应选用锌粒、稀盐酸;
(2)在题给装置中,a的作用保持分液漏斗和烧瓶内的气压相等,以保证分液漏斗内的液体能顺利加入烧瓶中;b主要是起安全瓶的作用,以防止倒吸;c为除去CO中的酸性气体,选用NaOH溶液,d为除去CO中的H2O,试剂选用浓硫酸;若用题给装置制备H2,则不需要酒精灯.
(2)在题给装置中,a的作用保持分液漏斗和烧瓶内的气压相等,以保证分液漏斗内的液体能顺利加入烧瓶中;b主要是起安全瓶的作用,以防止倒吸;c为除去CO中的酸性气体,选用NaOH溶液,d为除去CO中的H2O,试剂选用浓硫酸;若用题给装置制备H2,则不需要酒精灯.
解答:
解:(1)稀硝酸、浓硫酸具有强氧化性,因此制备氢气应选用锌粒、稀盐酸,化学方程式为Zn+2HCl=ZnCl2+H2↑,
故答案为:Zn+2HCl=ZnCl2+H2↑;
(2)甲酸在浓硫酸的作用下通过加热脱水即生成CO,由于甲酸易挥发,产生的CO中必然会混有甲酸,所以在收集之前需要除去甲酸,可以利用NaOH溶液吸收甲酸.又因为甲酸易溶于水,所以必需防止液体倒流,即b的作用是防止倒吸,最后通过浓硫酸干燥CO.为了使产生的气体能顺利的从发生装置中排出,就必需保持压强一致,因此a的作用是保持恒压;氢气密度小于空气的,因此要收集干燥的氢气,就只能用向下排空气法,而不能用排水法收集,
故答案为:恒压;防倒吸; NaOH溶液;浓H2SO4; .
.
故答案为:Zn+2HCl=ZnCl2+H2↑;
(2)甲酸在浓硫酸的作用下通过加热脱水即生成CO,由于甲酸易挥发,产生的CO中必然会混有甲酸,所以在收集之前需要除去甲酸,可以利用NaOH溶液吸收甲酸.又因为甲酸易溶于水,所以必需防止液体倒流,即b的作用是防止倒吸,最后通过浓硫酸干燥CO.为了使产生的气体能顺利的从发生装置中排出,就必需保持压强一致,因此a的作用是保持恒压;氢气密度小于空气的,因此要收集干燥的氢气,就只能用向下排空气法,而不能用排水法收集,
故答案为:恒压;防倒吸; NaOH溶液;浓H2SO4;
 .
.
点评:本题考查有机物合成方案的设计,题目难度较大,综合性较强,答题时注意把握物质的分离、提纯方法,把握物质的性质的异同是解答该题的关键.

练习册系列答案
相关题目
如图两瓶体积相等的气体,在同温、同压下瓶内气体的关系一定正确的是( )


| A、原子数相等 | B、密度相等 |
| C、质量相等 | D、摩尔质量相等 |