题目内容
向100mLBaCl2、AlCl3、FeCl3的混合溶液A中逐滴加入Na2SO4和NaOH的混合溶液B,产生沉淀的物质的量n和加入溶液B的体积关系如图所示:
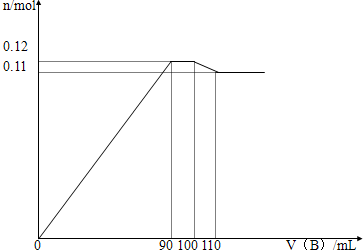
(1)当加入110mLB溶液时,溶液中的沉淀是 (填化学式).
(2)溶液B中Na2SO4和NaOH的物质的量浓度之比是 .
(3)将A、B溶液中各溶质的物质的量浓度(c)填入下表中.

(1)当加入110mLB溶液时,溶液中的沉淀是
(2)溶液B中Na2SO4和NaOH的物质的量浓度之比是
(3)将A、B溶液中各溶质的物质的量浓度(c)填入下表中.
| 溶质 | c/mol?L-1 |
| Na2SO4 | |
| NaOH | |
| BaCl2 | |
| AlCl3 | |
| FeCl3 |
考点:离子方程式的有关计算
专题:计算题
分析:(1)图中第一段曲线生成的沉淀为BaSO4、Fe(OH)3和Al(OH)3,且加入B溶液90mL时,Fe3+、Al3+恰好沉淀完全.
(2)图中第二段曲线为平行直线,沉淀总物质的量没有增减,故这段是由Al(OH)3的溶解和BaSO4的继续生成所引起,且溶解的Al(OH)3的物质的量和生成的BaSO4的物质的量相等;
(3)图中第三段曲线中,加入B溶液100mL时,Ba2+恰好沉淀完全,这段中Al(OH)3继续溶解,B为110mL时,沉淀中Al(OH)3已完全溶解.
图中第四段曲线中,沉淀为Fe(OH)3、BaSO4共1.1mol.
(2)图中第二段曲线为平行直线,沉淀总物质的量没有增减,故这段是由Al(OH)3的溶解和BaSO4的继续生成所引起,且溶解的Al(OH)3的物质的量和生成的BaSO4的物质的量相等;
(3)图中第三段曲线中,加入B溶液100mL时,Ba2+恰好沉淀完全,这段中Al(OH)3继续溶解,B为110mL时,沉淀中Al(OH)3已完全溶解.
图中第四段曲线中,沉淀为Fe(OH)3、BaSO4共1.1mol.
解答:
解:溶液中只有Fe3+被完全沉淀以后,Al3+才开始沉淀.
(1)图中第一段曲线生成的沉淀为BaSO4、Fe(OH)3和Al(OH)3,且加入B溶液90mL时,Fe3+、Al3+恰好沉淀,
故答案为:BaSO4、Fe(OH)3
(2)图中第二段曲线为平行直线,沉淀总物质的量没有增减,故这段是由Al(OH)3的溶解和BaSO4的继续生成所引起,且溶解的Al(OH)3的物质的量和生成的BaSO4的物质的量相等,据Al(OH)3+OH-=AlO2-+2H2O,Ba2++SO42-=BaSO4↓,故加入的物质:n(NaOH)=n(Na2SO4);
故答案为:1:1
(3)图中第三段曲线中,加入B溶液100mL时,Ba2+恰好沉淀完全,这段中Al(OH)3继续溶解,B为110mL时,沉淀中Al(OH)3已完全溶解,溶解了(0.12-0.11)mol=0.01mol,消耗了10mLB溶液,Al(OH)3+OH-=AlO2-+2H2O
0.01mol 0.01mol
故c(NaOH)=
=1mol/L,则共加入Na2SO4为0.01mol,故c(Na2SO4)=
=1mol/L,而整个反应过程共生成BaSO4为0.1L×1mol/L=0.1(mol)故A溶液中c(Ba2+)=
=1mol/L.
图中第四段曲线中,沉淀为Fe(OH)3、BaSO4共0.11mol,BaSO4为0.1mol,则Fe(OH)3为(0.11-0.1)mol=0.01mol,A中c(Fe3+)=
=0.1mol/L;第二、三段曲线共消耗B溶液20mL,n(NaOH)=1mol×0.02mol/L=0.02mol,据Al(OH)3+OH-=AlO2-+2H2O,则共溶解的Al(OH)3为0.02mol,则A中c(Al3+)=
=0.2mol?L-1.
故答案为:
(1)图中第一段曲线生成的沉淀为BaSO4、Fe(OH)3和Al(OH)3,且加入B溶液90mL时,Fe3+、Al3+恰好沉淀,
故答案为:BaSO4、Fe(OH)3
(2)图中第二段曲线为平行直线,沉淀总物质的量没有增减,故这段是由Al(OH)3的溶解和BaSO4的继续生成所引起,且溶解的Al(OH)3的物质的量和生成的BaSO4的物质的量相等,据Al(OH)3+OH-=AlO2-+2H2O,Ba2++SO42-=BaSO4↓,故加入的物质:n(NaOH)=n(Na2SO4);
故答案为:1:1
(3)图中第三段曲线中,加入B溶液100mL时,Ba2+恰好沉淀完全,这段中Al(OH)3继续溶解,B为110mL时,沉淀中Al(OH)3已完全溶解,溶解了(0.12-0.11)mol=0.01mol,消耗了10mLB溶液,Al(OH)3+OH-=AlO2-+2H2O
0.01mol 0.01mol
故c(NaOH)=
| 0.01mol |
| 0.01L |
| 0.01mol |
| 0.01L |
| 0.1mol |
| 0.1L |
图中第四段曲线中,沉淀为Fe(OH)3、BaSO4共0.11mol,BaSO4为0.1mol,则Fe(OH)3为(0.11-0.1)mol=0.01mol,A中c(Fe3+)=
| 0.01mol |
| 0.1L |
| 0.02mol |
| 0.1L |
故答案为:
| 溶质 | c/mol?L-1 |
| Na2SO4 | 1 |
| NaOH | 1 |
| BaCl2 | 1 |
| AlCl3 | 0.2 |
| FeCl3 | 0.1 |
点评:本题考查离子方程式的有关计算,题目难度较大,注意根据图象正确判断各阶段的离子反应,结合各阶段的各种物质的量进行计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、18 g D2O中含有的质子数目为10NA |
| B、7g乙烯和乙烷的混合气体中含有的氢原子数目为NA |
| C、标准状况下,22.4LCH3Cl中含有氯原子数目为NA |
| D、1 L0.5mol/LNa2CO3 溶液中含有的CO32-数目为0.5NA |
浓度为2mol?L-1的NaOH溶液150mL,吸收了4.48LCO2(标准状况).下列说法正确的是( )
| A、HCO3-离子数略多于CO32-离子数 |
| B、HCO3-离子数等于CO32-离子数 |
| C、HCO3-离子数略少于CO32-离子数 |
| D、Na+离子数等于HCO3-离子数和CO32-离子数之和 |
7.6克铜镁合金完全溶解于250mL密度为1.4g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体5.6L(标准状况),向反应后的溶液中加入1.0mol/L的KOH溶液,当金属离子全部沉淀时,得到12.7克沉淀.下列说法不正确的是( )
| A、该浓硝酸的物质的量浓度是14.0mol/L |
| B、得到12.7克沉淀时,加入的KOH溶液的体积是3.2L |
| C、该合金中铜与镁的物质的量之比是1:2 |
| D、NO2和N2O4的混合气体中,N2O4的体积分数是20% |
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是( )
| A、加入合金的质量可能为9.6g |
| B、参加反应的硝酸的物质的量为0.4mol |
| C、沉淀完全时消耗NaOH溶液体积为150mL |
| D、溶解合金时产生NO气体体积2.24L(STP) |
在容积为1L的干燥烧瓶中,用向下排空气法充入NH3后,测得烧瓶中的气体对氢气的相对密度为9.7.若将此气体进行喷泉实验,当喷泉停止后进入烧瓶中溶液的体积应为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )
| A、镀锌层破损后即对铁制品失去保护作用 |
| B、未通电前上述电镀装置可构成原电池,电镀过程是该原电池的充电过程 |
| C、电镀时保持电流恒定,升高温度不改变电解反应速率 |
| D、因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 |