题目内容
下列化学用语不正确的是:( )
| A、乙烯的结构简式:CH2=CH2 |
B、二氧化硫分子比例模型: |
| C、漂粉精的主要成分:CaCl2 |
| D、HCN分子的结构式:H-C≡N |
考点:结构简式,结构式,球棍模型与比例模型
专题:化学用语专题
分析:A、结构简式要标明官能团,乙烯的官能团是碳碳双键;
B、二氧化硫分子含有一个硫原子两个氧原子,硫原子半径大于氧原子半径,分子呈V型;
C、漂粉精的主要成分为CaClO,漂白粉的主要成分为CaCl2.
D、HCN分子中C原子核外有4个电子能形成4个共价键,N原子核外有5个电子能形成3个共价键,分子内含有-C≡N.
B、二氧化硫分子含有一个硫原子两个氧原子,硫原子半径大于氧原子半径,分子呈V型;
C、漂粉精的主要成分为CaClO,漂白粉的主要成分为CaCl2.
D、HCN分子中C原子核外有4个电子能形成4个共价键,N原子核外有5个电子能形成3个共价键,分子内含有-C≡N.
解答:
解:A、结构简式要标明官能团,乙烯的官能团是碳碳双键,乙烯的结构简式为CH2=CH2,故A正确;
B、二氧化硫分子含有一个硫原子两个氧原子,硫原子半径大于氧原子半径,分子呈V型,故B正确;
C、漂粉精的主要成分为Ca(ClO)2,漂白粉的主要成分为Ca(ClO)2、CaCl2,故C错误;
D、HCN分子中C原子核外有4个电子能形成4个共价键,N原子核外有5个电子能形成3个共价键,分子内含有-C≡N,故D正确.
故选:C.
B、二氧化硫分子含有一个硫原子两个氧原子,硫原子半径大于氧原子半径,分子呈V型,故B正确;
C、漂粉精的主要成分为Ca(ClO)2,漂白粉的主要成分为Ca(ClO)2、CaCl2,故C错误;
D、HCN分子中C原子核外有4个电子能形成4个共价键,N原子核外有5个电子能形成3个共价键,分子内含有-C≡N,故D正确.
故选:C.
点评:本题考查了中学常见的几种物质的结构简式、结构式、比例模型,难度不大,注意基础知识的积累.

练习册系列答案
相关题目
下列关于图的实验装置说法正确的是( )
A、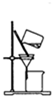 该图装置可以提纯精制氢氧化铁胶体 |
B、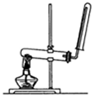 该图装置可以用来制备和收集氨气和氧气 |
C、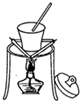 该图可以从食盐水中得到食盐晶体 |
D、 该图试管中放新制FeSO4溶液,从滴管中滴加NaOH溶液,易于观察到Fe(OH)2颜色 |
某气态烃在密闭容器内与氧气混合完全燃烧,如果燃烧前后容器内(温度高于1000C)压强保持不变,该烃可能是( )
| A、C2H6 |
| B、C2H4 |
| C、C3H8 |
| D、C3H6 |
单质碘的熔沸点较低,其原因是( )
| A、碘的非金属性较弱 |
| B、碘分子中键能较小 |
| C、碘晶体中碘分子间以范德华力结合 |
| D、I-I共价键的键长较长 |
H2O与H2S结构相似,都是V型的极性分子,但是H2O的沸点是100℃,H2S的沸点是-60.7℃.引起这种差异的主要原因是( )
| A、范德华力 | B、共价键 |
| C、氢键 | D、相对分子质量 |
已知硫化亚铜与一定浓度的硝酸共热,所得溶液中只有硝酸铜和硫酸铜,放出一氧化氮和二氧化氮两种气体,且两种气体的物质的量之比为3:7,则参加反应的硫化亚铜和作氧化剂的硝酸的物质的量之比是( )
| A、4:25 | B、2:17 |
| C、1:7 | D、3:8 |
鉴别晶体与非晶体最可靠的科学方法是( )
| A、红外光谱 | B、X射线衍射实验 |
| C、质谱 | D、原子光谱 |
X、Y、Z、M是原子序数依次递增的短周期元素,Z原子核外电子总数等于X和Y 核外电子数总数之和,X、Z、M分别得到一个电子后均形成稀有气体原子的稳定电子层结构.下列说法正确的是( )
| A、X分别与Y和Z形成的化合物原子个数比不可能相同 |
| B、X与Y形成的化合物的沸点比X与Z形成的化合物的沸点低 |
| C、1mol CaY2与SO2发生氧化还原反应时,转移2mol电子 |
| D、CaX2、CaY2、CaZ2和CaM2等4种化合物中,阳离子与阴离子个数比均为1:2 |