题目内容
一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s)?KCl(l)+NaAlSi3O8(s).
(1)上述反应涉及的第三周期元素中,离子半径最小的是 (用元素符号表示).Cl原子与Si原子可以形成的五核分子,其化学键长和键角都相等,则该物质为 分子(填“极性”或“非极性”).
(2)上述元素的最高价氧化物对应水化物中,既能与强酸又能与强碱反应,其原因在于: (用电离方程式表示).
(3)Na和O2反应形成Na2O和Na2O2的混合物,阴阳离子的个数比为 .用电子式表示Na2O2的形成过程: .
(4)不能用于比较Na与Al金属性相对强弱的事实是 .
A.最高价氧化物对应水化物的碱性 B.Na和AlCl3溶液反应
C.单质与H2O反应的难易程度 D.比较同浓度NaCl和AlCl3的pH值.
(1)上述反应涉及的第三周期元素中,离子半径最小的是
(2)上述元素的最高价氧化物对应水化物中,既能与强酸又能与强碱反应,其原因在于:
(3)Na和O2反应形成Na2O和Na2O2的混合物,阴阳离子的个数比为
(4)不能用于比较Na与Al金属性相对强弱的事实是
A.最高价氧化物对应水化物的碱性 B.Na和AlCl3溶液反应
C.单质与H2O反应的难易程度 D.比较同浓度NaCl和AlCl3的pH值.
考点:微粒半径大小的比较,元素周期律的作用,不同晶体的结构微粒及微粒间作用力的区别,电解质在水溶液中的电离
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:(1)涉及短周期元素有Na、Al、Si、Cl,电子层结构相同,核电荷数越大离子半径越小、电子层越多离子半径越大;SiCl4分子结构对称为非极性分子;
(2)能与强酸又能与强碱反应为氢氧化铝,为两性氢氧化物;
(3)Na2O由钠离子与氧离子构成、Na2O2由钠离子与过氧根离子构成,阴阳离子的个数比都是1:2;用钠原子、氧原子的电子式表示过氧化钠的形成;
(4)比较金属性强弱,可根据对应的最高价氧化物的水化物的碱性、金属与酸、水反应的剧烈程度等角度进行判断.
(2)能与强酸又能与强碱反应为氢氧化铝,为两性氢氧化物;
(3)Na2O由钠离子与氧离子构成、Na2O2由钠离子与过氧根离子构成,阴阳离子的个数比都是1:2;用钠原子、氧原子的电子式表示过氧化钠的形成;
(4)比较金属性强弱,可根据对应的最高价氧化物的水化物的碱性、金属与酸、水反应的剧烈程度等角度进行判断.
解答:
解:(1)涉及短周期元素有Na、Al、Si、Cl,阴离子有3个电子层,阳离子有2个电子层,核电荷数越大大的离子半径小,则离子半径最小的为Al;
Cl原子与Si原子可以形成的五核分子,其化学键长和键角都相等,分子为正四面体结构,为非极性分子,其故答案为:Al;非极性;
(2)能与强酸又能与强碱反应为氢氧化铝,为两性氢氧化物,可发生酸式电离和碱式电离,为H++AlO2-+H2O?Al(OH)3?Al3++3OH-,
故答案为:H++AlO2-+H2O?Al(OH)3?Al3++3OH-;
(3)Na2O由钠离子与氧离子构成、Na2O2由钠离子与过氧根离子构成,阴阳离子的个数比都是1:2,故混合物中阴阳离子的个数比是1:2;用钠原子、氧原子的电子式表示过氧化钠的形成为: ,
,
故答案为:1:2; ;
;
(4)比较金属性强弱,可根据对应的最高价氧化物的水化物的碱性、金属与酸、水反应的剧烈程度等角度,比较同浓度NaCl和AlCl3的pH值,可以说明氢氧化钠与氢氧化铝的碱性强弱,而Na和AlCl3溶液反应,是钠与水反应,不能比较Na、Al金属性强弱,
故答案为:B.
Cl原子与Si原子可以形成的五核分子,其化学键长和键角都相等,分子为正四面体结构,为非极性分子,其故答案为:Al;非极性;
(2)能与强酸又能与强碱反应为氢氧化铝,为两性氢氧化物,可发生酸式电离和碱式电离,为H++AlO2-+H2O?Al(OH)3?Al3++3OH-,
故答案为:H++AlO2-+H2O?Al(OH)3?Al3++3OH-;
(3)Na2O由钠离子与氧离子构成、Na2O2由钠离子与过氧根离子构成,阴阳离子的个数比都是1:2,故混合物中阴阳离子的个数比是1:2;用钠原子、氧原子的电子式表示过氧化钠的形成为:
 ,
,故答案为:1:2;
 ;
;(4)比较金属性强弱,可根据对应的最高价氧化物的水化物的碱性、金属与酸、水反应的剧烈程度等角度,比较同浓度NaCl和AlCl3的pH值,可以说明氢氧化钠与氢氧化铝的碱性强弱,而Na和AlCl3溶液反应,是钠与水反应,不能比较Na、Al金属性强弱,
故答案为:B.
点评:本题考查较为综合,涉及微粒半径比较、分子结构与性质、电子式、元素周期律等知识,为高频考点,题目设置贴近高考,难度适中,注意相关基础知识的积累,注意用电子式表示化学键或物质的形成过程.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
关于3Cl2+6KOH═KClO3+5KCl+3H2O的反应,以下说法正确的是( )
| A、Cl2是氧化剂,KOH是还原剂 |
| B、被还原的氯元素的质量是被氧化的氯元素质量的5倍 |
| C、若反应中消耗12mol KOH,则转移10mol电子 |
| D、将KClO3和KCl的混合物加入到硫酸中反应,不可能产生Cl2 |
 某实验小组学生用50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应、通过测定反应过程中所放出的热量计算反应热.下列说法正确的是( )
某实验小组学生用50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应、通过测定反应过程中所放出的热量计算反应热.下列说法正确的是( )| A、如图条件下实验过程中没有热量损失 |
| B、若改用60mL 0.50mol/L盐酸跟50mL 0.55mol/L的NaOH溶液进行反应,通过测定反应过程中所放出的热量相等 |
| C、图中实验装置缺少环形玻璃搅拌棒 |
| D、烧杯间填满碎纸条的作用是固定小烧杯 |


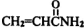 )具有中等毒性.A-K几种有机物间的转化关系如图所示(部分条件和产物略去).已知:A为气态烃,标准状况下密度为2.5g/L,且核磁共振氢谱有4个吸收峰;G比丙烯酰胺多一个CH2原子团.
)具有中等毒性.A-K几种有机物间的转化关系如图所示(部分条件和产物略去).已知:A为气态烃,标准状况下密度为2.5g/L,且核磁共振氢谱有4个吸收峰;G比丙烯酰胺多一个CH2原子团.