题目内容
二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料.以CH4和 H2O为原料制备二甲醚和甲醇的工业流程如图1.请填空:
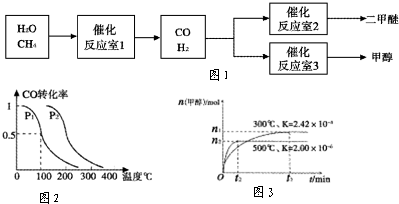
(1)在一定条件下,反应室1中发生反应:
CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0.
在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”).将1.0mol CH4和2.0mol H2O通入反应室1(假设容积为10L),1min末有 0.1molCO生成,则1min内反应的平均速率v(H2)= mol/(L?min).
(2)已知:CO的燃烧热为283kJ/mol;
CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-1323kJ/mol
2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol
在一定条件下,反应室2的可逆反应除生成二甲醚外还生成了气态水,该热化学方程式为 .(本题涉及的条件均在同一条件下)
(3)反应室3中在催化剂作用下发生如下反应:CO(g)+2H2(g)?CH3OH(g).
对此反应进行如下研究:
①在压强为0.1MPa条件下,容积为2L时,充入0.2mol CO与0.4mol H2在催化剂作用下反应生成甲醇.CO的平衡转化率与温度、压强的关系如图2所示.则p1 p2 (填“<”、“>”或“=”);在p1压强下,100℃时,若温度不变,反应CO(g)+2H2(g)?CH3OH(g)的平衡常数K的值为 ,再加入1.0 mol CO后重新达到平衡,则CO的转化率 (填“增大”、“不变”或“减小”),CH3OH的体积分数 (填“增大”、“不变”或“减小”).
②在容积为1L的密闭容器中分别充入1mol CO和 2mol H2,实验测得甲醇的物质的量和温度、时间的关系曲线如图3所示.则该正反应的△H 0(填“<”、“>”或“=”),判断的理由是 .
(4)我国某科研所提供一种碱性“直接二甲醚燃料电池”.该燃料电池负极的电极反应式为:CH3OCH3-12e-+16OH-═2CO
+11H2O.
有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入NaHSO3溶液中得SO2气体回收.
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下VL的废气,计算消耗二甲醚的质量. .

(1)在一定条件下,反应室1中发生反应:
CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0.
在其它条件不变的情况下降低温度,逆反应速率将
(2)已知:CO的燃烧热为283kJ/mol;
CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-1323kJ/mol
2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol
在一定条件下,反应室2的可逆反应除生成二甲醚外还生成了气态水,该热化学方程式为
(3)反应室3中在催化剂作用下发生如下反应:CO(g)+2H2(g)?CH3OH(g).
对此反应进行如下研究:
①在压强为0.1MPa条件下,容积为2L时,充入0.2mol CO与0.4mol H2在催化剂作用下反应生成甲醇.CO的平衡转化率与温度、压强的关系如图2所示.则p1
②在容积为1L的密闭容器中分别充入1mol CO和 2mol H2,实验测得甲醇的物质的量和温度、时间的关系曲线如图3所示.则该正反应的△H
(4)我国某科研所提供一种碱性“直接二甲醚燃料电池”.该燃料电池负极的电极反应式为:CH3OCH3-12e-+16OH-═2CO
2- 3 |
有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入NaHSO3溶液中得SO2气体回收.
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下VL的废气,计算消耗二甲醚的质量.
考点:化学平衡的计算,用盖斯定律进行有关反应热的计算,化学电源新型电池,反应速率的定量表示方法,化学反应速率的影响因素,转化率随温度、压强的变化曲线
专题:化学反应中的能量变化,化学平衡专题,化学反应速率专题,电化学专题
分析:(1)降低温度正、逆反应速率都降低;根据方程式计算生成的氢气的物质的量,进而计算氢气的浓度变化,根据v=
计算v(H2);
(2)反应室2的可逆反应除生成二甲醚外还生成了气态水,根据盖斯定律计算;
(3)依据图象分析,随温度升高,一氧化碳转化率减小,平衡逆向进行,逆向是吸热反应,正向是放热反应;依据平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到;
(4)依据化学反应转化关系,热量电池电极饱和氯化钠溶液生成的氢氧化钠吸收二氧化硫,结合电子守恒进行计算.
| △c |
| △t |
(2)反应室2的可逆反应除生成二甲醚外还生成了气态水,根据盖斯定律计算;
(3)依据图象分析,随温度升高,一氧化碳转化率减小,平衡逆向进行,逆向是吸热反应,正向是放热反应;依据平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到;
(4)依据化学反应转化关系,热量电池电极饱和氯化钠溶液生成的氢氧化钠吸收二氧化硫,结合电子守恒进行计算.
解答:
解:(1)降低温度逆反应速率减小;
1min末有0.1mol CO生成,根据方程式CH4(g)+H2O(g)?CO(g)+3H2(g)可知,生成的氢气为0.1mol×3=0.3mol,容器的体积为10L,
则1min内用氢气表示的平均速率v(H2)=
=0.03mol/(L?min);
故答案为:减小;0.03;
(2)已知:①CO的燃烧热为283kJ/mol,则CO(g)+
O2(g)═CO2(g)△H=-283kJ/mol;
②CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-1323kJ/mol
③2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol
利用盖斯定理将①×2+③×2-②可得:
2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-2×(-283kJ/mol)+2×(-484kJ/mol)-(-1323kJ/mol)=-211kJ/mol,
故答案为:2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-211kJ/mol;
(3)①由图可知温度相同时,到达平衡时,压强为p2的CO转化率高,平衡向正反应方向移动,反应为气体体积减小的反应,增大压强平衡向体积减小的方向移动,即p1<p2;
CO的起始浓度为
=0.1mol/L,H2的起始浓度为
=0.2mol/L,由图2可知,在p1压强下,100℃时,CO的转化率为0.5,CO的浓度变化量为0.1mol/L×0.5=0.05mol/L,则:
CO(g)+2H2(g)?CH3OH(g)
开始(mol/L):0.1 0.2 0
变化(mol/L):0.05 0.1 0.05
平衡(mol/L):0.05 0.1 0.05
所以平衡常数k=
=100,
若温度不变,再加入1.0 mol CO后重新达到平衡,虽然平衡向正方向移动,但转化的比加入的少,则转化率减小;CH3OH的体积分数减小;
故答案为:<;100;减小;减小;
②从图象可以看出,升高温度,甲醇的物质的量减少,说明正反应是放热反应,则△H<0,
故答案为:<,升高温度甲醇的物质的量减少,反应向吸热方向进行;
(4)CH3OCH3-12e-+16OH-═2CO2-3+11H2O,2H++2e-═H2↑,2NaCl+2H2O
2NaOH+H2↑+Cl2↑,SO2+NaOH═NaHSO3,得到CH3OCH3~12SO2,依据条件计算,设二甲醚质量为X;
CH3OCH3~12SO2
46 12mol
x
x=
g;
故答案为:
g.
1min末有0.1mol CO生成,根据方程式CH4(g)+H2O(g)?CO(g)+3H2(g)可知,生成的氢气为0.1mol×3=0.3mol,容器的体积为10L,
则1min内用氢气表示的平均速率v(H2)=
| ||
| 1min |
故答案为:减小;0.03;
(2)已知:①CO的燃烧热为283kJ/mol,则CO(g)+
| 1 |
| 2 |
②CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-1323kJ/mol
③2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol
利用盖斯定理将①×2+③×2-②可得:
2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-2×(-283kJ/mol)+2×(-484kJ/mol)-(-1323kJ/mol)=-211kJ/mol,
故答案为:2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-211kJ/mol;
(3)①由图可知温度相同时,到达平衡时,压强为p2的CO转化率高,平衡向正反应方向移动,反应为气体体积减小的反应,增大压强平衡向体积减小的方向移动,即p1<p2;
CO的起始浓度为
| 0.2mol |
| 2L |
| 0.4mol |
| 2L |
CO(g)+2H2(g)?CH3OH(g)
开始(mol/L):0.1 0.2 0
变化(mol/L):0.05 0.1 0.05
平衡(mol/L):0.05 0.1 0.05
所以平衡常数k=
| 0.05 |
| 0.05×0.12 |
若温度不变,再加入1.0 mol CO后重新达到平衡,虽然平衡向正方向移动,但转化的比加入的少,则转化率减小;CH3OH的体积分数减小;
故答案为:<;100;减小;减小;
②从图象可以看出,升高温度,甲醇的物质的量减少,说明正反应是放热反应,则△H<0,
故答案为:<,升高温度甲醇的物质的量减少,反应向吸热方向进行;
(4)CH3OCH3-12e-+16OH-═2CO2-3+11H2O,2H++2e-═H2↑,2NaCl+2H2O
| ||
CH3OCH3~12SO2
46 12mol
x
| V |
| 22.4 |
x=
| 23V |
| 134.4 |
故答案为:
| 23V |
| 134.4 |
点评:本题考查了热化学方程式的书写方法,化学平衡的分析判断,平衡常数计算应用,原电池、电解池原理中的电子守恒计算,综合考查学生的分析能力和计算能力,较为综合,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列离子方程式正确的是( )
| A、明矾溶液中加入过量的氨水:Al3++4OH-═AlO2-+2H2O |
| B、漂白粉溶液中通入过量的二氧化碳:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO+CO32- |
| C、FeBr2溶液中加入过量的氯水:2Br-+Cl2═Br2+2Cl- |
| D、澄清的石灰水中加入过量的NaHCO3溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
下列说法中,错误的是( )
| A、非金属元素可能形离子化合物 |
| B、成键原子间原子轨道重叠的越多,共价键越牢固 |
| C、对双原子分子来说,键能越大,含有该键的分子越稳定 |
| D、键长越长,化学键越牢固 |
25℃时,Ksp[AgCl]=1.8×10-10,Ksp[AgBr]=1.0×10-12.下列说法正确的是( )
| A、25℃时,饱和AgCl溶液与饱和AgBr溶液相比,后者的c(Ag+)较大 |
| B、25℃时,若向AgBr的饱和溶液中加入少量AgCl的固体,则c(Br-)将减小 |
| C、25℃时,向饱和AgCl水溶液中加入NaCl溶液,Ksp[AgCl]将变大 |
| D、25℃时,在AgBr的悬浊液中加入NaCl溶液后,AgBr不可能转化为AgCl |
以两块质量相同的铜板为电极,电解足量的AgNO3溶液,一段时间后,溶液质量减少了7.6g,则下列说法中正确的是( )
| A、电解过程共转移了0.05mol电子 |
| B、阳极质量减少,阴极质量增加 |
| C、两电极的质量差为14g |
| D、两电极的质量差为7.6g |
 右图是某只含有C、H、O、N的有机物简易球棍模型.下列关于该有机物的说法正确的是( )
右图是某只含有C、H、O、N的有机物简易球棍模型.下列关于该有机物的说法正确的是( )| A、该有机物是天然高分子化合物 |
| B、在一定条件下,可以通过聚合反应,生成高分子化合物 |
| C、不能和盐酸溶液反应 |
| D、不能和NaHCO3溶液反应,生成CO2 |