题目内容
11. 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:(1)铁的核外电子排布式为[Ar]3d64s2 或1s22s22p63s23p63d64s2.
(2)配合物Fe(CO)x 常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x 晶体属于分子晶体(填晶体类型).Fe(CO)x 的中心原子价电子数与配体提供电子数之和为18,则x=5.
(3)K3[Fe(CN)6]的配体CN-中碳原子杂化轨道类型为sp,C、N、O 三元素的电负性由大到小的顺
序为N>O>C(用元素符号表示).
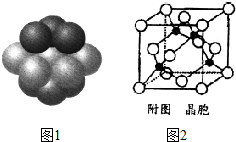
(4)铜晶体铜原子的堆积方式如图1示.
①铜位于元素周期表的ds区.
②每个铜原子周围距离最近的铜原子数目12.
(5)某M 原子的外围电子排布式为3s23p5,铜与M 形成化合物的晶胞如附图2所示(黑点代表铜原子).该晶体中铜原子和M 原子之间的最短距离为a pm,阿伏伽德罗常数为NA,则该晶体的密度为$\frac{\frac{4×99.5}{{N}_{A}}}{(\frac{4\sqrt{3}}{3}a)^{3}}×1{0}^{30}$g/cm3 (只写计算式).
分析 (1)根据原子核外电子排布规律,铁原子核外有26个电子;
(2)分子晶体的熔沸点较低;配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,据此判断x值;
(3)根据C原子价层电子对个数确定杂化方式;一般来说非金属性越强,第一电离能越大,但是因为p轨道半充满体系具有很强的稳定性,会有特例,如N的p轨道本来就是半充满的,O的p轨道失去一个电子才是半充满的,所以O比N容易失去电子;
(4)①根据Cu原子的价电子排布判断;
②根据晶胞结构图可知,铜为面心立方堆积,据此判断每个铜原子周围距离最近的铜原子数目;
(5)计算出一个晶胞中微粒数,利用化合物的摩尔质量和晶胞边长计算出密度,根据晶胞的结构可知,铜原子和M原子之间的最短距离为立方体体对角线的$\frac{1}{4}$.
解答 解:(1)Fe原子核外有26个电子,根据核外电子排布规律,Fe原子核外电子排布为[Ar]3d64s2 或1s22s22p63s23p63d64s2,故答案为:[Ar]3d64s2 或1s22s22p63s23p63d64s2;
(2)分子晶体的熔沸点较低,根据题给信息知,该物质的熔沸点较低,所以为分子晶体,配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5,故答案为:分子晶体;5;
(3)CN-中C原子价层电子对个数=1+$\frac{1}{2}$(4+1-1×3)=2,所以采取sp杂化;一般来说非金属性越强,第一电离能大,但是因为p轨道半充满体系具有很强的稳定性.N的p轨道本来就是半充满的.O的p轨道失去一个电子才是半充满的.所以C、N、O三元素的第一电离能由大到小的顺序为N>O>C,故答案为:sp;N>O>C;
(4)①Cu是29号元素,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,价层电子为3d104s1,属于ds区,故答案为:ds;
②根据晶胞结构图可知,铜为面心立方堆积,所以每个铜原子周围距离最近的铜原子位于经过该原子的立方体的面的面心上,共有12个,故答案为:12;
(5)M 原子的外围电子排布式为3s23p5,则M为Cl元素,在铜与氯形成化合物的晶胞中Cu原子数目为4,Cl原子数目为$8×\frac{1}{8}+4×\frac{1}{2}$=4,故化学式为CuCl,一个晶胞的摩尔质量为4×99.5g/mol,1molCuCl含有$\frac{{N}_{A}}{4}$个晶胞,铜原子和M原子之间的最短距离为立方体体对角线的$\frac{1}{4}$,而体对角线为晶胞边长的$\sqrt{3}$倍,设晶胞的边长为x,有$\frac{1}{4}$×$\sqrt{3}$x=a,解得x=$\frac{4\sqrt{3}}{3}$apm=$\frac{4\sqrt{3}}{3}$×10-10cm,因此1molCuCl的体积为$\frac{{N}_{A}}{4}$×($\frac{4\sqrt{3}}{3}$a×10-10cm)3,密度为$\frac{99.5g}{\frac{{N}_{A}}{4}×(\frac{4\sqrt{3}}{3}a×1{0}^{-10}cm)^{3}}$=$\frac{\frac{4×99.5}{{N}_{A}}}{(\frac{4\sqrt{3}}{3}a)^{3}}×1{0}^{30}$g/cm3,故答案为:$\frac{\frac{4×99.5}{{N}_{A}}}{(\frac{4\sqrt{3}}{3}a)^{3}}×1{0}^{30}$.
点评 本题考查较为全面,涉及到电子排布式、第一电离能、杂化类型的判断、配合物以及有关晶体的计算,但解题具有较强的方法性和规律性,学习中注意总结如何书写电子排布式,如何判断分子空间构型以及有关晶体计算等方法.

 阅读快车系列答案
阅读快车系列答案| A. | c(CN-)<c(HCN) | B. | c(HCN)+c(CN-)═0.04 mol/L | ||
| C. | c(OH-)═c(H+)+c(HCN) | D. | c(Na+)>c(CN-)>c(H+)>c(OH-) |
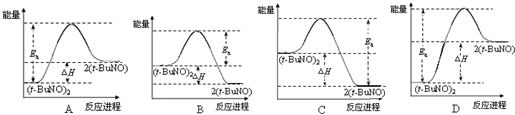
| A. |  | B. | 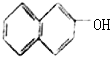 | C. | 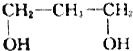 | D. | 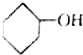 |
请回答下列问题:
(1)化学计量数a的值为1.
(2)下列能说明该反应达到了化学平衡状态的是ac(填序号).
a.容器内气体的压强一定b.容器内气体的密度一定
c.容器内Z的分子数一定d.容器内气体的质量一定
(3)维持T℃温度不变,若起始时向容器M中加入2mol X、1mol Y和1mol Ar(稀有气体不参与反应),则反应达到平衡后放出的热量是Q1kJ.若起始时向容器M中加入4mol X和6mol Y,反应达到平衡时容器内的分子数目减少10%,则反应中放出的热量为QkJ.
(4)维持T℃温度不变,若在一个和原容器体积相等的恒压容器N中加入2mol X和1mol Y,发生题给反应并达到平衡,则N(填“M”或“N”)容器中的反应先达到平衡状态,容器中X的质量分数M>N(填“>”、“<”或“=”).
(5)已知:该反应的平衡常数随温度的变化情况如表所示:
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
| A. | 混合气体的颜色不再改变 | |
| B. | 混合气体的密度不再改变 | |
| C. | 混合气体的压强不再改变 | |
| D. | 混合气体的平均相对分子质量不再改变 |
| A. | KMnO4→K2MnO4 | B. | HCl→Cl2 | C. | Fe3+→Fe2+ | D. | Na2O→NaOH |