题目内容
(1)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为 (阿伏加德罗常数的值用NA表示),放出的热量为 kJ.
(2)已知稀溶液中,1mol H2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式 .
(3)甲硅烷(SiH4)是一种无色液体,遇到空气能发生爆炸性自燃,生成(SiO2)和水.已知室温下10g甲硅烷自燃放出热量446kJ,表示其燃烧热的热化学方程式为: .
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1mol Cl2参与反应时释放145kJ的热量,写出这个反应的热化学方程式: .
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为
(2)已知稀溶液中,1mol H2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式
(3)甲硅烷(SiH4)是一种无色液体,遇到空气能发生爆炸性自燃,生成(SiO2)和水.已知室温下10g甲硅烷自燃放出热量446kJ,表示其燃烧热的热化学方程式为:
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1mol Cl2参与反应时释放145kJ的热量,写出这个反应的热化学方程式:
考点:有关反应热的计算,热化学方程式
专题:化学反应中的能量变化
分析:(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1,②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ?mol-1,利用盖斯定律将
可得CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),△H=-
kJ?mol-1=867kJ?mol-1,以此解答该题;
(2)依据中和热的概念是强酸强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应反应焓变得到;
(3)根据甲硅烷的质量计算1mol甲硅烷燃烧放出的热量,结合化学方程式书写热化学方程式.注意物质的聚集状态和反应热的单位等问题;
(4)依据热化学方程式书写方法写出,标注物质聚集状态和对应焓变.
| ①+② |
| 2 |
| 574+1160 |
| 2 |
(2)依据中和热的概念是强酸强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应反应焓变得到;
(3)根据甲硅烷的质量计算1mol甲硅烷燃烧放出的热量,结合化学方程式书写热化学方程式.注意物质的聚集状态和反应热的单位等问题;
(4)依据热化学方程式书写方法写出,标注物质聚集状态和对应焓变.
解答:
解:(1)已知①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1,②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ?mol-1,
利用盖斯定律将
可得CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),△H=-
kJ?mol-1=867kJ?mol-1,n(CH4)=0.2mol,整个过程中转移的电子总数为0.2mol×8NA=1.6NA=9.6×1023,
放出的热量为0.2mol×867kJ?mol-1=173.4kJ,
故答案为:1.6NA;173.4;
(2)1mol H2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,H2SO4与NaOH反应的中和热的热化学方程式为:
H2SO4(aq)+NaOH(aq)=
Na2SO4(aq)+H2O (l)△H=-57.3 kJ?mol-1,
故答案为:
H2SO4(aq)+NaOH(aq)=
Na2SO4(aq)+H2O (l)△H=-57.3 kJ?mol-1;
(3)n(SiH4)=
=
mol,则1molSiH4燃烧放出的热量为:446kJ×
=1427.2kJ,
反应的化学方程式为:SiH4+O2=SiO2+2H2O,则热化学方程式为:SiH4(g)+O2(g)=SiO2(g)+2H2O(l)△H=-1427.2kJ/mol,
故答案为:SiH4(g)+O2(g)=SiO2(g)+2H2O(l)△H=-1427.2kJ/mol;
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1mol Cl2参与反应时释放145kJ的热量,2mol氯气完全反应放热290 kJ,热化学方程式为2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290 kJ?mol-1,
故答案为:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290 kJ?mol-1.
利用盖斯定律将
| ①+② |
| 2 |
| 574+1160 |
| 2 |
放出的热量为0.2mol×867kJ?mol-1=173.4kJ,
故答案为:1.6NA;173.4;
(2)1mol H2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,H2SO4与NaOH反应的中和热的热化学方程式为:
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:
| 1 |
| 2 |
| 1 |
| 2 |
(3)n(SiH4)=
| 10g |
| 32g/mol |
| 10 |
| 32 |
| 32 |
| 10 |
反应的化学方程式为:SiH4+O2=SiO2+2H2O,则热化学方程式为:SiH4(g)+O2(g)=SiO2(g)+2H2O(l)△H=-1427.2kJ/mol,
故答案为:SiH4(g)+O2(g)=SiO2(g)+2H2O(l)△H=-1427.2kJ/mol;
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1mol Cl2参与反应时释放145kJ的热量,2mol氯气完全反应放热290 kJ,热化学方程式为2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290 kJ?mol-1,
故答案为:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290 kJ?mol-1.
点评:本题考查反应热以及氧化还原反应的计算,侧重于学生的计算能力和分析能力的考查,注意盖斯定律的应用,题目难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
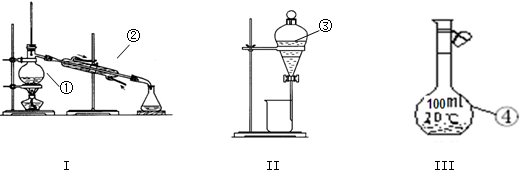


 据图回答下列问题:
据图回答下列问题:
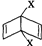 和
和 之外,还有多种同分异构体,
之外,还有多种同分异构体,