题目内容
工业上一般在恒容密闭容器中可以采用以下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H

(1)该反应的逆反应速率随时间变化的关系如图1.t1时改变了某种条件,改变的条件可能是升高了温度、 、 (填写2项)
(2)若该反应在恒温恒压下进行,判断反应达到平衡状态的依据是 .
A.混合气体的平均相对分子质量不变
B.2v(H2)(逆)=v(CO)(正)
C.容器内CO、H2、CH3OH的浓度之比为1:2:1
D.CH3OH、CO、H2的浓度都不再发生变化
E.混合气体的密度不变
(3)在一定温度下,若将4a mol H2和2a mol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为 .若此时再向该容器中投入a mol CO、2a mol H2和a mol CH3OH,判断平衡移动的方向是 (“正向”“逆向”或“不移动”)
(4)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)═4NO2(g)+O2(g)△H>0下表为反应在T1温度下的部分实验数据
则500s内NO2的平均生成速率为 .
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图2所示,其中Y为CO2.
写出石墨I电极上发生反应的电极反应式 .在电解池中生成N2O5的电极反应式为 .

(1)该反应的逆反应速率随时间变化的关系如图1.t1时改变了某种条件,改变的条件可能是升高了温度、
(2)若该反应在恒温恒压下进行,判断反应达到平衡状态的依据是
A.混合气体的平均相对分子质量不变
B.2v(H2)(逆)=v(CO)(正)
C.容器内CO、H2、CH3OH的浓度之比为1:2:1
D.CH3OH、CO、H2的浓度都不再发生变化
E.混合气体的密度不变
(3)在一定温度下,若将4a mol H2和2a mol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为
(4)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)═4NO2(g)+O2(g)△H>0下表为反应在T1温度下的部分实验数据
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图2所示,其中Y为CO2.
写出石墨I电极上发生反应的电极反应式
考点:化学反应速率变化曲线及其应用,化学电源新型电池,反应速率的定量表示方法,化学平衡的影响因素,化学平衡状态的判断
专题:基本概念与基本理论
分析:(1)图象分析可知是逆反应速率增大,反应是否达到平衡不知,所以增大逆反应速率的因素均符合;
(2)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
(3)依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念就是得到,通过计算浓度商和平衡常数比较分析判断反应进行的方向;
(4)①根据
计算速率;
②燃料原电池中,负极上燃料失电子发生氧化反应;先根据化合价判断生成N2O5的电极,再根据离子的放电顺序写出电极反应式.
(2)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
(3)依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念就是得到,通过计算浓度商和平衡常数比较分析判断反应进行的方向;
(4)①根据
| △c |
| t |
②燃料原电池中,负极上燃料失电子发生氧化反应;先根据化合价判断生成N2O5的电极,再根据离子的放电顺序写出电极反应式.
解答:
解:(1)图象分析可知是逆反应速率增大,反应是否达到平衡不知,所以增大逆反应速率的因素均符合,如加压、增加甲醇浓度、升高温度、使用催化剂等,
故答案为:加压;增加甲醇浓度、使用催化剂等;
(2)判断反应达到平衡状态的依据正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化;
A.反应前后,混合气体的物质的量改变,气体的质量不变,反应达到平衡状态时,混合气体的相对平均分子质量不变,所以能作为判断平衡状态的依据,故A正确;
B.当反应达到平衡状态时,v(H2)(逆)=2v(CO)(正),故B错误;
C.容器内CO、H2、CH3OH的浓度之比为1:2:1,和起始量,变化量有关,不能作为平衡的标志,故C错误;
D.反应达到平衡状态时,CH3OH、CO、H2的浓度都不再发生变化,所以能作为判断平衡状态的依据,故D正确;
E.混合物的质量始终不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为判断平衡状态的依据,故E错误;
故选AD;
(3)在一定温度下,若将4a mol H2和2a mol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) a 2a 0
变化量(mol/L)50%×a a 0.5a
平衡量(mol/L)0.5a a 0.5a
则该反应的平衡常数K=
=
;
若此时再向该容器中投入a mol CO、2a mol H2和a mol CH3OH,浓度为c(CO)=
mol/L+0.5amol/L=amol/L,c(H2)=
mol+amol/L=2amol,c(CH3OH)=
mol/L+0.5amol/L=amol/L,Q=
=
<K=
,判断平衡移动的方向是反应正向进行,
故答案为:
;正向;
①因为△c(NO2)=2×(5.00-3.52)mol?L-1=2.96mol?L-1,500s内NO2的平均生成速率为
=0.00592 mol?L-1?s-1,故答案为:0.00592 mol?L-1?s-1;
②燃料原电池中,负极上燃料失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为H2+CO32--2e-=CO2+H2O;
N2O5中氮元素的化合价是+5价,而硝酸中氮元素也是+5价.因此应该在左侧生成N2O5,即在阳极区域生成,据电极反应离子放电顺序可知:阴极发生2H++2e-=H2↑的反应,则阳极为N2O4+2HNO3-2e-=2N2O5+2H+.
故答案为:H2+CO32--2e-=CO2+H2O;N2O4+2HNO3-2e-=2N2O5+2H+.
故答案为:加压;增加甲醇浓度、使用催化剂等;
(2)判断反应达到平衡状态的依据正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化;
A.反应前后,混合气体的物质的量改变,气体的质量不变,反应达到平衡状态时,混合气体的相对平均分子质量不变,所以能作为判断平衡状态的依据,故A正确;
B.当反应达到平衡状态时,v(H2)(逆)=2v(CO)(正),故B错误;
C.容器内CO、H2、CH3OH的浓度之比为1:2:1,和起始量,变化量有关,不能作为平衡的标志,故C错误;
D.反应达到平衡状态时,CH3OH、CO、H2的浓度都不再发生变化,所以能作为判断平衡状态的依据,故D正确;
E.混合物的质量始终不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为判断平衡状态的依据,故E错误;
故选AD;
(3)在一定温度下,若将4a mol H2和2a mol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) a 2a 0
变化量(mol/L)50%×a a 0.5a
平衡量(mol/L)0.5a a 0.5a
则该反应的平衡常数K=
| 0.5a |
| 0.5a×a2 |
| 1 |
| a2 |
若此时再向该容器中投入a mol CO、2a mol H2和a mol CH3OH,浓度为c(CO)=
| a |
| 2 |
| 2a |
| 2 |
| a |
| 2 |
| a |
| a×(2a)2 |
| 1 |
| 4a2 |
| 1 |
| a2 |
故答案为:
| 1 |
| a2 |
①因为△c(NO2)=2×(5.00-3.52)mol?L-1=2.96mol?L-1,500s内NO2的平均生成速率为
| 2.96mol?L-1 |
| 500s |
②燃料原电池中,负极上燃料失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为H2+CO32--2e-=CO2+H2O;
N2O5中氮元素的化合价是+5价,而硝酸中氮元素也是+5价.因此应该在左侧生成N2O5,即在阳极区域生成,据电极反应离子放电顺序可知:阴极发生2H++2e-=H2↑的反应,则阳极为N2O4+2HNO3-2e-=2N2O5+2H+.
故答案为:H2+CO32--2e-=CO2+H2O;N2O4+2HNO3-2e-=2N2O5+2H+.
点评:本题为拼合型,涉及化学反应速率计算、化学平衡移动与计算、平衡常数的计算与运用、原电池原理等知识点,题量大,计算量较大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
下列用品的有效成分正确的是( )
A、 KAl(SO4)2?12H2O |
B、 Na2CO3 |
C、 C6H12O6 |
D、 NaClO |

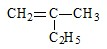
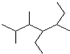 的名称
的名称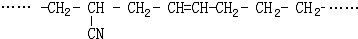 则合成它的单体是
则合成它的单体是