题目内容
工业上吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(1)Na2S2O4中S元素的化合价为 .
(2)写出装置Ⅱ中反应的离子方程式 .
(3)装置Ⅲ中电解槽阴极发生的电极反应为 .
(4)从装置Ⅳ获得粗产品NH4NO3的实验操作依次为 、 过滤、洗涤等.

(1)Na2S2O4中S元素的化合价为
(2)写出装置Ⅱ中反应的离子方程式
(3)装置Ⅲ中电解槽阴极发生的电极反应为
(4)从装置Ⅳ获得粗产品NH4NO3的实验操作依次为
考点:二氧化硫的化学性质,氮的氧化物的性质及其对环境的影响
专题:元素及其化合物
分析:一氧化氮、二氧化硫经过盛有氢氧化钠溶液的装置Ⅰ反应生成亚硫酸氢钠,将二氧化硫吸收,剩余的一氧化氮在装置Ⅱ中在酸性环境下,NO和Ce4+之间会发生氧化还原反应生成硝酸根、亚硝酸根离子,装置Ⅲ中电解亚硫酸氢钠溶液生成Na2S2O4,剩余溶液在装置Ⅳ中通入氧气、氨气发生反应生成硝酸铵,
(1)依据化合价代数和为0;
(2)在酸性环境下,NO和Ce4+之间会发生氧化还原反应;
(3)在电解池中,阳极上发失去电子的氧化反应,阴极上发生得电子的还原反应;
(4)根据获得粗产品的实验步骤来分析.
(1)依据化合价代数和为0;
(2)在酸性环境下,NO和Ce4+之间会发生氧化还原反应;
(3)在电解池中,阳极上发失去电子的氧化反应,阴极上发生得电子的还原反应;
(4)根据获得粗产品的实验步骤来分析.
解答:
解:(1)Na2S2O4中钠元素为+1价,氧元素为-2价,依据代数和为0,可知硫元素化合价为+3价;
故答案为:+3;
(2)在酸性环境下,NO和Ce4+之间会发生氧化还原反应:NO+3Ce4++2H2O=3Ce3++NO3-+4H+,NO+Ce4++H2O=Ce3++NO2-+2H+;
故答案为:NO+3Ce4++2H2O=3Ce3++NO3-+4H+,NO+Ce4++H2O=Ce3++NO2-+2H+;
(3)电解池的阴极发生得电子的还原反应,电极反应式为:2HSO3--2e-+2H+=S2O42-+2H2O
,故答案为:2HSO3--2e-+2H+=S2O42-+2H2O;
(4)获得粗产品的实验步骤为蒸发浓缩、冷却结晶、过滤、洗涤等,故答案为:蒸发浓缩、冷却结晶;
故答案为:蒸发浓缩 冷却结晶.
故答案为:+3;
(2)在酸性环境下,NO和Ce4+之间会发生氧化还原反应:NO+3Ce4++2H2O=3Ce3++NO3-+4H+,NO+Ce4++H2O=Ce3++NO2-+2H+;
故答案为:NO+3Ce4++2H2O=3Ce3++NO3-+4H+,NO+Ce4++H2O=Ce3++NO2-+2H+;
(3)电解池的阴极发生得电子的还原反应,电极反应式为:2HSO3--2e-+2H+=S2O42-+2H2O
,故答案为:2HSO3--2e-+2H+=S2O42-+2H2O;
(4)获得粗产品的实验步骤为蒸发浓缩、冷却结晶、过滤、洗涤等,故答案为:蒸发浓缩、冷却结晶;
故答案为:蒸发浓缩 冷却结晶.
点评:本题为工艺流程题,考查了含氮元素、含硫元素物质的性质知识,熟悉相关物质的性质和电解原理是解题关键,题目难度中等.

练习册系列答案
相关题目
下列物质的用途利用其物理性质的是( )
| A、草酸用作还原剂 |
| B、生石灰用作干燥剂 |
| C、苯用作萃取剂 |
| D、铁粉用作抗氧化剂 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、1.0mol?L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B、甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- |
| C、与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
| D、c(H+)/c(OH-)=1×10-13的溶液K+、Na+、CH3COO-,Br- |
水溶液中下列离子能大量共存的是( )
| A、K+、Fe3+、C6H5O-、HCO3- |
| B、H+、Cu2+、MnO4-、SO42- |
| C、Mg2+、Ag+、CO32-、NO3- |
| D、Na+、Al3+、BrO-、S2- |
已知β一紫罗兰酮的结构简式是 ,下列关于该有机物的说法正确的是( )
,下列关于该有机物的说法正确的是( )
 ,下列关于该有机物的说法正确的是( )
,下列关于该有机物的说法正确的是( )| A、其分子式为C13H18O |
| B、能发生加成反应、取代反应、水解反应 |
| C、属于芳香族化合物 |
| D、能使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色 |
化合物A(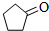 )可由环戊烷经三步反应合成:
)可由环戊烷经三步反应合成: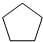
X
Y
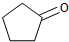
则下列说法错误的是( )
 )可由环戊烷经三步反应合成:
)可由环戊烷经三步反应合成:
| 反应1 |
| 反应2 |
| 反应3 |

则下列说法错误的是( )
| A、反应1可用试剂是氯气 |
| B、反应3可用的试剂是氧气和铜 |
| C、反应1为取代反应,反应2为消去反应 |
| D、A可通过加成反应合成Y |
 :Ca2++2HCO
:Ca2++2HCO +2OH-
+2OH- CaCO3↓+CO
CaCO3↓+CO +2H2O
+2H2O