题目内容
水溶液中下列离子能大量共存的是( )
| A、K+、Fe3+、C6H5O-、HCO3- |
| B、H+、Cu2+、MnO4-、SO42- |
| C、Mg2+、Ag+、CO32-、NO3- |
| D、Na+、Al3+、BrO-、S2- |
考点:离子共存问题
专题:
分析:A.铁离子与C6H5O-、碳酸氢根离子发生双水解反应;
B.四种离子之间不满足离子反应发生条件;
C.镁离子、银离子与碳酸根离子反应生成沉淀;
D.硫离子和铝离子发生双水解反应,BrO-、S2-之间发生氧化还原反应.
B.四种离子之间不满足离子反应发生条件;
C.镁离子、银离子与碳酸根离子反应生成沉淀;
D.硫离子和铝离子发生双水解反应,BrO-、S2-之间发生氧化还原反应.
解答:
解:A.Fe3+与C6H5O-、HCO3-之间发生双水解反应,在溶液中不能大量共存,故A错误;
B.H+、Cu2+、MnO4-、SO42-之间不发生反应,在溶液中能够大量共存,故B正确;
C.Mg2+、Ag+与CO32-之间反应生成沉淀,在溶液中不能大量共存,故C错误;
D.BrO-、S2-之间发生氧化还原反应,Al3+、S2-之间发生双水解反应,在溶液中不能大量共存,故D错误;
故选B.
B.H+、Cu2+、MnO4-、SO42-之间不发生反应,在溶液中能够大量共存,故B正确;
C.Mg2+、Ag+与CO32-之间反应生成沉淀,在溶液中不能大量共存,故C错误;
D.BrO-、S2-之间发生氧化还原反应,Al3+、S2-之间发生双水解反应,在溶液中不能大量共存,故D错误;
故选B.
点评:本题考查离子共存的判断,为中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
从植物中分离出的活性化合物zeylastral的结构简式如图所示,下列说法不正确的是( )

| A、化合物 zeylastral可以发生水解反应 |
| B、能与FeCl3溶液、银氨溶液发生反应 |
| C、1mol zeylastral最多与5molH2发生反应 |
| D、1mol zeylastral最多可与2molBr2发生反应 |
下列说法正确的是( )
| A、甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 |
| B、分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种 |
C、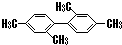 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 |
D、1mol有机物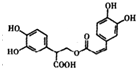 一定条件下能和7molNaOH反应. 一定条件下能和7molNaOH反应. |
元素X~Z是元素周期表中4种主族元素,其性质或结构信息如下表,有关下列元素的描述错误的是( )
| 元素 | X | Y | W | Z |
| 相关信息 | 用硫酸处理海藻灰时,可得通常状况下为紫黑色的固体,其制剂可用来消毒. | 工业上在冰晶石存在的条件下,用电解法制取其单质. | 最早是在用氯气处理提取食盐后的盐水母液中发现的,被称作“海洋元素”. | 原子的电子总数是最外层电子数的6倍 |
| A、实验室可在海藻灰的浸出液中滴加双氧水来制取元素X的单质 |
| B、元素X、Y的单质充分混合后滴加少量水,可看到大量紫色蒸汽生成,说明该反应会放出大量的热 |
| C、元素X的气态氢化物的沸点高于元素W的气态氢化物的沸点 |
| D、元素Z是一种较活泼的金属元素,可用铝热法从Z的氧化物中制备Z的单质 |
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol?L-1NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中不正确的是( )
| A、当金属全部溶解时,失去电子的物质的量为0.3 mol |
| B、当金厲全部溶解时收集NO气体体积为2.24 L |
| C、当生成的沉淀量达最大时,消耗NaOH溶液的体积V≥100 mL |
| D、参加反应的金属总质量为9.6 g>m>3.6 g |


 在一定条件下可水解为
在一定条件下可水解为 和R2-NH2,则F在强酸和长时间加热条件下发生水解反应,水解产物的结构简式为
和R2-NH2,则F在强酸和长时间加热条件下发生水解反应,水解产物的结构简式为