题目内容
1.某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否象H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题.请你参与活动并完成下列研究:(一)制取氨气
(1)实验室制备氨气,下列方法中适宜选用的是②(填编号)
①氯化铵溶液与氢氧化钠溶液共热; ②固体氢氧化钠中滴加浓氨水;
③固态氯化铵加热分解; ④固态硝酸铵加热分解;
(2)写出实验室制取氨气的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(二)实验探究
该小组成员设计实验探究氨气还原性及产物,提供实验装置如下:
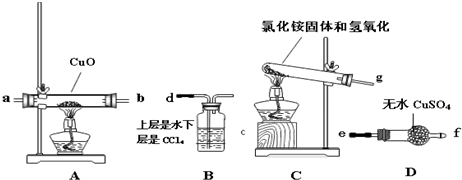
(3)请你根据提供的装置从左至右连接接口序号g→ab→ef→d
(4)该装置在设计上有一定的缺陷,为确保实验结果的准确性,你对该装置的改进措施是在装置C和A之间连接一个盛有碱石灰的干燥管.
(5)利用改进后的装置进行实验,观察到CuO全部变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体.请写出NH3与CuO反应的化学方程式3CuO+2NH3 $\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+N2+3H2O.
(6)装置B的作用是:吸收尾气,防止倒吸;隔绝空气,防止空气中水蒸气进入D中.
(三)提出并解决问题
(7)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O.已知Cu2O是红色粉末,是一种碱性氧化物,在酸性溶液中,Cu+能自身发生氧化还原反应.请你设计一个简单的实验检验该红色物质中是否含有Cu2O:取少量样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之,则没有.
分析 (1)①氨气极易溶于水;
②固体氢氧化钠溶于水放热,电离产生氢氧根离子,结合一水合氨电离平衡移动影响因素;
③加热氯化铵生成氨气和氯化氢,氨气和氯化氢遇冷又生成氯化铵;
④硝酸铵分解会得到氮的氧化物等杂质;
(2)实验室用氯化铵和消石灰反应制备氨气,反应生成氯化钙、氨气和水;
(3)C制备氨气,A装置中氨气与CuO反应,D装置检验氨气与CuO反应生成水,B装置进行尾气处理,并防止水蒸气加入D中;
(4)制备的氨气中含有水蒸气,加入A装置需要干燥,防止对D中水蒸气检验的影响;
(5)CuO全部变为红色物质,说明生成Cu,无水CuSO4变蓝,说明生成水,同时生成一种无污染的气体为氮气;
(6)B装置的用途为:吸收尾气,防止倒吸;隔绝空气,防止空气中水蒸气进入D中;
(7)在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu与Cu2+.
解答 解:(1)①氨气极易溶于水,不适合制备氨气,故①错误;
②固体氢氧化钠溶于水放热,电离产生氢氧根离子,氢氧根离子浓度增大,抑制了氨气的电离,有利于氨气的逸出,故②正确;
③加热氯化铵生成氨气和氯化氢,氨气和氯化氢遇冷又生成氯化铵,不能制得氨气,故③错误;
④硝酸铵分解会得到氮的氧化物等杂质,不适合制备氨气,故④错误.
故选:②;
(2)实验室用氯化铵和消石灰反应制备氨气,反应生成氯化钙、氨气和水,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)C制备氨气,A装置中氨气与CuO反应,D装置检验氨气与CuO反应生成水,B装置进行尾气处理,并防止水蒸气加入D中,装置从左至右连接接口序号为:g→ab→ef→d,
故答案为:g→ab→ef→d;
(4)制备的氨气中含有水蒸气,加入A装置需要干燥,防止对D中水蒸气检验的影响,该装置的改进措施是:在装置C和A之间连接一个盛有碱石灰的干燥管,
故答案为:在装置C和A之间连接一个盛有碱石灰的干燥管;
(5)CuO全部变为红色物质,说明生成Cu,无水CuSO4变蓝,说明生成水,同时生成一种无污染的气体为氮气,反应方程式为:3CuO+2NH3 $\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+N2+3H2O,
故答案为:3CuO+2NH3 $\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+N2+3H2O;
(6)B装置的用途为:吸收尾气,防止倒吸;隔绝空气,防止空气中水蒸气进入D中,
故答案为:吸收尾气,防止倒吸;隔绝空气,防止空气中水蒸气进入D中;
(7)在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu与Cu2+,检验该红色物质中是否含有Cu2O的实验方案为:取少量样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之,则没有,
故答案为:取少量样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之,则没有.
点评 本题物质性质探究实验方案,关键是对实验原理的理解,试题有利于培养学生的分析、理解能力及化学实验能力.

| A. | MgO | B. | NaOH | C. | CaCl2 | D. | CO2 |
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤沸点:NH3<PH3<AsH3.
| A. | ①②⑤ | B. | ①③④ | C. | ①②③⑤ | D. | ①③⑤ |
| A. | 乙酸的结构简式:CH3COOH | B. | Na2O2中氧元素的化合价为-2 | ||
| C. | Cl-的结构示意图: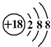 | D. | 乙烯的结构简式CH2CH2 |
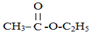 相关物质间转化关系如图:
相关物质间转化关系如图: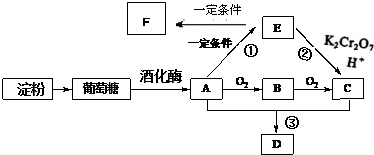
 +CH2CH2OH$?_{△}^{浓硫酸}$
+CH2CH2OH$?_{△}^{浓硫酸}$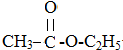 +H2O
+H2O

 .
. .
. .
.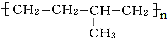 的链节为-CH2-CH2-CH(CH3)-CH2-.
的链节为-CH2-CH2-CH(CH3)-CH2-.