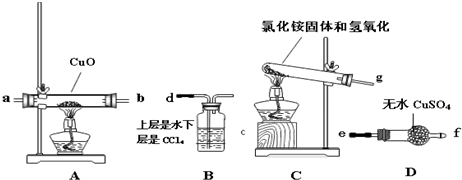
题目内容
16.下列叙述不正确的是( )①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤沸点:NH3<PH3<AsH3.
| A. | ①②⑤ | B. | ①③④ | C. | ①②③⑤ | D. | ①③⑤ |
分析 ①元素的非金属性越强,其氢化物的稳定性越强;
②金属晶体的熔沸点与金属键成正比,金属键与电荷成正比、与半径成反比;
③第ⅠA、ⅡA族元素的阳离子与其上一周期稀有气体元素的原子具有相同的核外电子排布,但H元素除外;
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素,为过渡元素;
⑤氢化物的熔沸点与其相对分子质量成正比,含有氢键的熔沸点较高.
解答 解:①元素的非金属性越强,其氢化物的稳定性越强,非金属性F>O>S,则氢化物的稳定性HF>H2O>H2S,故错误;
②金属晶体的熔沸点与金属键成正比,金属键与电荷成正比、与半径成反比,Na、K电荷相等,Al的电荷较大、半径大小为K>Na>Al,则熔点:Al>Na>K,故正确;
;
③第ⅠA、ⅡA族元素的阳离子与其上一周期稀有气体元素的原子具有相同的核外电子排布,但H元素除外,氢离子核外没有电子,故错误;
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素,为过渡元素,故正确;
⑤氢化物的熔沸点与其相对分子质量成正比,含有氢键的熔沸点较高,氨气中含有氢键,则沸点:PH3<AsH3<NH3,故错误;
故选D.
点评 本题考查元素周期律,为高频考点,明确同一周期、同一主族元素原子结构和元素周期律关系是解本题关键,知道非金属性、金属性强弱比较方法,注意氢化物的熔沸点与氢键有关,题目难度不大.

练习册系列答案
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
6.若某阴离子的结构示意图如图所示,则该元素在元素周期表中的位置可能是( )
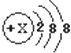
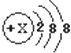
| A. | 第四周期IA | B. | 第三周期0族 | C. | 第二周期VIIA | D. | 第三周期VIIA族 |
7.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1 mol Na2O2与足量CO2反应转移的电子数目为0.1 NA | |
| B. | 标准状况下,2.24 L CCl4中的分子数目为0.1 NA | |
| C. | 0.1 mol•L-1NaOH溶液中Na+的数目为0.1 NA | |
| D. | 3.2 g O2和O3的混合物含有的分子数目为0.1 NA |
8.关于某溶液中所含离子的检验,下列判断正确的是( )
| A. | 加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不消失,则原溶液中一定含SO42- | |
| B. | 用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色的火焰,则原溶液中一定不含K+ | |
| C. | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中滴几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ | |
| D. | 取少量晶体溶于水,加入少量NaOH溶液,加热,在试管口用湿润的蓝色石蕊试纸检验,若变红,则可证明晶体的成分中含有NH4+ |
6.据中国新闻网报道,青岛尾气遥感检测车上岗,0.7秒测出尾气超标车辆.汽车尾气净化的反应如下:NO(g)+CO(g)???$\frac{1}{2}$N2(g)+CO2(g)△H=-373.4kJ•mol-1.下列说法正确的是( )
| A. | 升高温度,平衡常数增大 | |
| B. | 当v(CO2)正=$\frac{1}{2}$v(N2)逆时,说明反应达到平衡状态 | |
| C. | 增加CO的物质的量浓度,NO的转化率增大 | |
| D. | 增大压强,正反应速率增大,逆反应速率减小 |