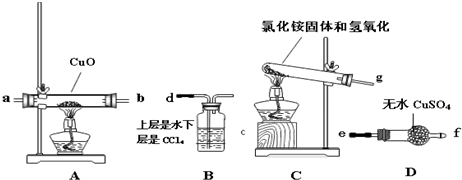
题目内容
13.高聚物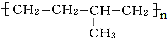 的链节为-CH2-CH2-CH(CH3)-CH2-.
的链节为-CH2-CH2-CH(CH3)-CH2-.
分析 高聚物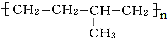 去掉左右[]和聚合度n既是其链节.
去掉左右[]和聚合度n既是其链节.
解答 解:高聚物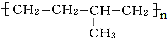 的单体为乙烯、丙烯,去掉左右[]和聚合度n即可得到链节为:-CH2-CH2-CH(CH3)-CH2-,
的单体为乙烯、丙烯,去掉左右[]和聚合度n即可得到链节为:-CH2-CH2-CH(CH3)-CH2-,
故答案为:-CH2-CH2-CH(CH3)-CH2-.
点评 本题考查有机高分子化合物的结构和性质,难度不大,掌握加成聚合反应的断键、成键情况是解题的关键.

练习册系列答案
相关题目
3.下列对元素周期表说法错误的是( )
| A. | 7个横行 | B. | 7个周期 | C. | 18纵行 | D. | 18个族 |
8.关于某溶液中所含离子的检验,下列判断正确的是( )
| A. | 加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不消失,则原溶液中一定含SO42- | |
| B. | 用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色的火焰,则原溶液中一定不含K+ | |
| C. | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中滴几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ | |
| D. | 取少量晶体溶于水,加入少量NaOH溶液,加热,在试管口用湿润的蓝色石蕊试纸检验,若变红,则可证明晶体的成分中含有NH4+ |
18.如图是一些常见有机物的转化关系,关于反应①~⑦的说法不正确的是( )
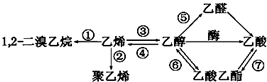

| A. | 反应①③是加成反应 | B. | 反应②是加聚反应 | ||
| C. | 只有反应⑦是取代反应 | D. | 反应④是消去反应 |
2.pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为l×10-3mol•L-1,则该溶液中溶质的pC=-lg(1×l0-3)=3.如图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图.下列说法不正确的是( )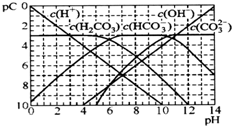

| A. | H2CO3、HCO3-、CO32-不能在同一溶液中大量共存 | |
| B. | H2CO3电离平衡常数Kal≈10-6 | |
| C. | pH=7时,溶液中存在关系(HCO3-)>c(H2CO3)>c(CO32-) | |
| D. | pH=9时,溶液中存在关系(H+)+c(H2CO3)=c(OH-)+c(CO32-) |
3.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂.
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:
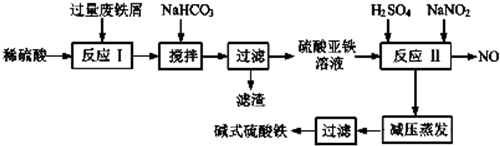
已知部分阳离子以氧氧化物形式沉淀的溶液的pH见表.回答下列问题:
(1)碱式硫酸铁能够净水的原因是能水解生成具有吸附能力较强的胶体.
(2)加入少量NaHCO3的目的是调节溶液的pH,使溶液中的Al3+沉淀.
(3)假设沉淀完全溶解时溶液中金属离子的浓度为1.0×10-5mol•L-1,试估算Ksp[Fe(OH)2]=10-15.
(4)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,该反应的离子方程式为2H++Fe2++NO3-=Fe3++NO↑+H2O
(5)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(6)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-,某同学根据提供的试剂设计实验检验所得产品中不含Fe2+,含有SO42-,可供选择的试剂如下:
A.新制氯水 B.0.l mol•L -1KSCN溶液
C.10%NaOH溶液 D.20%HNO3溶液
E.0.05mol•L-1酸性KMnO4溶液 F.0.1mol•L-1BaCl2溶液
请你帮助该同学完成实验,将相关项目填入表中:
(7)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.已知:
2Fe2++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
则溶液中铁元素的总含量为5.6g•L-1.
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.0 | 4.4 |
(1)碱式硫酸铁能够净水的原因是能水解生成具有吸附能力较强的胶体.
(2)加入少量NaHCO3的目的是调节溶液的pH,使溶液中的Al3+沉淀.
(3)假设沉淀完全溶解时溶液中金属离子的浓度为1.0×10-5mol•L-1,试估算Ksp[Fe(OH)2]=10-15.
(4)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,该反应的离子方程式为2H++Fe2++NO3-=Fe3++NO↑+H2O
(5)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(6)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-,某同学根据提供的试剂设计实验检验所得产品中不含Fe2+,含有SO42-,可供选择的试剂如下:
A.新制氯水 B.0.l mol•L -1KSCN溶液
C.10%NaOH溶液 D.20%HNO3溶液
E.0.05mol•L-1酸性KMnO4溶液 F.0.1mol•L-1BaCl2溶液
请你帮助该同学完成实验,将相关项目填入表中:
| 实验操作 | 现象 | 结论 |
| 取适量产品于洁净烧杯中,加入适量蒸馏水,充分搅拌,静置,滤去沉淀 | 得红棕色溶液 | 溶液中含有Fe3+ |
| 取少量溶液于试管中,滴加0.05mol/L的酸性高锰酸钾溶液 | 溶液不褪色 | 溶液中不含Fe2+ |
| 取少量溶液于试管中,滴加0.1mol/L的氯化钡溶液,再加入20%稀硝酸溶液 | 有白色沉淀 | 溶液中含有SO${\;}_{4}^{2-}$ |
2Fe2++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
则溶液中铁元素的总含量为5.6g•L-1.