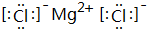题目内容
11. 合理使用药物是保证身心健康、提高生活质量的有效手段.药物化学已经成为化学的一个重要领域.
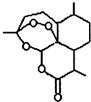
合理使用药物是保证身心健康、提高生活质量的有效手段.药物化学已经成为化学的一个重要领域.(1)我国科学家屠呦呦因发现治疗疟疾的特效药--青蒿素,而获得2015年诺贝尔生理学或医学奖.青蒿素的结构简式如图所示,其含有的过氧基(-O-O-)具有强氧化性.请回答下列问题:
①青蒿素的分子式为C15H22O5.
②下列有关青蒿素的叙述中,正确的是BD(填字母).
A、青蒿素属于芳香族化合物
B、青蒿素具有强氧化性,可用于杀菌
C、青蒿素分子中的所有碳原子在同一个平面上
D、在一定条件下,青蒿素能与NaOH溶液发生反应
(2)阿司匹林(乙酰水杨酸)
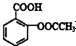 是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为:
是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为: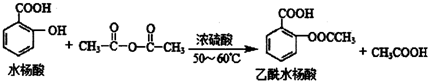
请回答下列问题:
①乙酰水杨酸中的含氧官能团的名称为羧基、酯基.
②制得的阿司匹林中常含有少量的杂质水杨酸,下列试剂可用于检验阿司匹林样品中是否混有水杨酸的是B(填字母).
A、碳酸氢钠溶液 B、三氯化铁溶液 C、石蕊试液
③写出水杨酸与足量的NaHCO3溶液完全反应所得有机产物的结构简式:
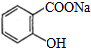 .
.④1mol乙酰水杨酸与足量的NaOH溶液反应,最多消耗NaOH物质的量为3mol.
分析 (1)①根据青蒿素的结构简式书写分子式;
②A.含有苯环的化合物属于芳香族化合物
B.青蒿素含有的过氧基(-O-O-)具有强氧化性;
C.青蒿素分子中存在1个碳原子连接的4个原子的四面体结构;
D.青蒿素分子中含有酯基,具有酯的性质;
(2)①乙酰水杨酸中的含氧官能团为羧基、酯基;
②水杨酸中含有酚羟基,而乙酰水杨酸中不能酚羟基,可以用酚羟基与氯化铁溶液显色反应鉴别;
③水杨酸中羧基能与碳酸氢钠反应,而酚羟基不能与NaHCO3溶液反应;
④乙酰水杨酸中羧基、酯基均能与氢氧化钠反应,但酯基为羧酸与酚形成,1mol酯基能与2mol氢氧化钠反应.
解答 解:(1)①根据青蒿素的结构简式,可知其分子式为C15H22O5,故答案为:C15H22O5;
②A.青蒿素变化苯环,不属于芳香族化合物,故A错误;
B.青蒿素含有的过氧基(-O-O-)具有强氧化性,可用于杀菌,故B正确;
C.青蒿素分子中存在1个碳原子连接的4个原子的四面体结构,分子中所有碳原子不可能处于同一平面内,故C错误;
D.青蒿素分子中含有酯基,具有酯的性质,在一定条件下,青蒿素能与NaOH溶液发生反应,故D正确,
故选:BD;
(2)①乙酰水杨酸中的含氧官能团为羧基、酯基,故答案为:羧基、酯基;
②水杨酸与乙酰水杨酸均含有羧基,均能与碳酸氢钠溶液反应,均可以使石蕊溶液保红色,水杨酸中含有酚羟基,而乙酰水杨酸中不能酚羟基,可以用酚羟基与氯化铁溶液显色反应鉴别,故选:B;
③水杨酸中羧基能与碳酸氢钠反应,而酚羟基不能与NaHCO3溶液反应,反应产物结构简式为: ,故答案为:
,故答案为: ;
;
④乙酰水杨酸中羧基、酯基均能与氢氧化钠反应,但酯基为羧酸与酚形成,1mol酯基能与2mol氢氧化钠反应,1mol乙酰水杨酸与足量的NaOH溶液反应,最多消耗NaOH物质的量为3mol,故答案为:3.
点评 本题考查有机物的结构与性质,是对有机化学基础的综合考查,(2)中④为易错点,注意酯基水解得到羧基、酚羟基均与氢氧化钠反应.

| A. | 容器Ⅰ、Ⅱ中正反应速率不相同 | |
| B. | 容器Ⅰ中CO 的物质的量比容器Ⅱ中的多 | |
| C. | 容器I中反应的平衡常数小于Ⅲ中 | |
| D. | 容器Ⅲ中CO 的浓度比容器II中CO浓度的2倍还多 |
| A. | 用FeCl溶液腐蚀印刷电路板Fe3++Cu═Fe2++Cu2+ | |
| B. | 少量CO2通入澄清石灰水中:CO2+Ca2++2OH-═CaCO3↓+H2O | |
| C. | 钠与水的反应:Na+H2O═Na++OH-+H2↑ | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
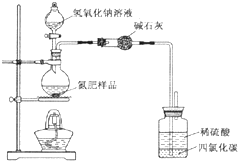 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:氢氧化钠少量时2NH4HSO4+2NaOH═(NH4)2SO4+Na2SO4+2H2O
氢氧化钠过量时NH4HSO4+2NaOH═Na2SO4+NH3↑+2H2O
(1)同学们设计的实验装置图如图,请回答相关问题.
①装置中碱石灰的作用是吸收氨气中的水蒸气.
②广口瓶内四氯化碳的作用是防止倒吸.
③指导老师指出,用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外逸,测得的样品含氮量仍将偏低,其原因可能是残留在反应装置中的氨气未被稀硫酸吸收.
(2)同学们改进实验装置后(改进装置图略),进行如下实验.
称取不同质量的上述样品分别与40.00mL相同浓度的氢氧化钠溶液混合,完全溶解后,加热充分反应(此温度下铵盐不分解),并使生成的氨气全部被稀硫酸吸收,测得氨气的质量.部分实验数据如下:
| 氢氧化钠溶液体积/mL | 40.00mL | ||
样品质量/g | 7.750 | 15.50 | 23.25 |
氨气质量/g | 1.870 | 1.870 | 1.700 |
①样品中氮元素的质量分数是19.87%.
②所用氢氧化钠溶液的物质的量浓度为3.25 mol/L.
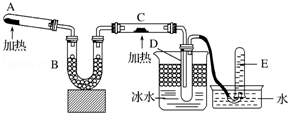 化学是一门以实验为基础的自然科学.
化学是一门以实验为基础的自然科学. 周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,其中F为过渡元素,已知A原子2p轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期形成的单质中是最高的;F2+核外各电子层电子均已充满.
周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,其中F为过渡元素,已知A原子2p轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期形成的单质中是最高的;F2+核外各电子层电子均已充满.
 .
.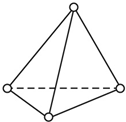 (1)根据要求填空:
(1)根据要求填空: