题目内容
下列关于强、弱电解质的叙述,有错误的是( )
| A、电解质本身不一定能导电 |
| B、在溶液中,导电能力弱的电解质不一定是弱电解质 |
| C、纯净的强电解质在液态时,有的导电,有的不导电 |
| D、SO2的水溶液能导电,所以SO2是电解质 |
考点:强电解质和弱电解质的概念
专题:电离平衡与溶液的pH专题
分析:A、电解质如果不含有自由移动的离子就不能导电,如氯化钠晶体、HCl;
B、导电能力与离子浓度、离子的电荷数有关,与电解质的强弱无关;
C、NaCl,K2SO4液态时导电,AlCl3,HCl液态时不导电;
D、SO2本身不能电离出离子,是非电解质.
B、导电能力与离子浓度、离子的电荷数有关,与电解质的强弱无关;
C、NaCl,K2SO4液态时导电,AlCl3,HCl液态时不导电;
D、SO2本身不能电离出离子,是非电解质.
解答:
解:A、电解质如果不含有自由移动的离子就不能导电,如氯化钠晶体|HCl,故A正确;
B、导电能力与离子浓度、离子的电荷数有关,与电解质的强弱无关,故B正确;
C、离子化合物类强电解质,液态时导电,它们都含有活泼的金属和活泼非金属,且熔点都高.如NaCl,K2SO4等,共价化合物类强电解质,液态时不导电,如AlCl3,HCl等,它们的熔点都较低,故C正确;
D、SO2本身不能电离出离子,是非电解质,故D错误;
故选D.
B、导电能力与离子浓度、离子的电荷数有关,与电解质的强弱无关,故B正确;
C、离子化合物类强电解质,液态时导电,它们都含有活泼的金属和活泼非金属,且熔点都高.如NaCl,K2SO4等,共价化合物类强电解质,液态时不导电,如AlCl3,HCl等,它们的熔点都较低,故C正确;
D、SO2本身不能电离出离子,是非电解质,故D错误;
故选D.
点评:本题考查强弱电解质与导电能力的关系,难度不大,注意离子化合物类强电解质,液态时导电,它们都含有活泼的金属和活泼非金属,且熔点都高.如NaCl,K2SO4等,共价化合物类强电解质,液态时不导电,如AlCl3,HCl等.

练习册系列答案
 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目
短周期主族元素A、B、C、D、E的原子序数依次增大,其单质常温下有三种气态两种固态,A和B形成的气态化合物的水溶液可使干燥红色石蕊试纸变蓝,A和C同主族,D原子最外层电子数与电子层数相等,E的原子半径在同周期最小,则下列说法不正确的是( )
| A、原子半径大小:C>D>E>A |
| B、A、C的氧化物均可能含有非极性键 |
| C、B、C、D的最高价氧化物对应的水化物能两两反应 |
| D、工业中常用电解熔融DE3制备单质D |
以NA 表示阿伏加德罗常数,下列说法正确的是( )
| A、34gH2O2中含有的阴离子数为2NA | ||
| B、15.6 g Na2O2 与过量CO2反应时,转移的电子数为0.4NA | ||
| C、1mol/LNH4Cl溶液中含NH4+数小于NA | ||
D、14g分子式为CnH2n的(n≥2)链烃中含有的C=C的数目一定为
|
有人建议有AG来表示溶液的酸度,AG的定义为AG=lg[c(H+)/c(OH-)].则下列表述正确的是( )
| A、在25℃时,若溶液呈中性,则pH=7,AG=1 |
| B、在25℃时,若溶液呈酸性,则pH<7 AG<0 |
| C、在25℃时,若溶液呈碱性,则pH>7 AG>0 |
| D、在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH) |
下列离子方程式书写正确的是( )
| A、用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | ||||
B、用铜为电极电解饱和食盐水:2Cl-+2H2O
| ||||
| C、FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | ||||
| D、Ba(OH)2溶液中滴加过量NaHSO4:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
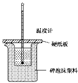 某实验小组学生按照课本实验要求,用50mL0.5mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量计算中和热.下列说法正确的是( )
某实验小组学生按照课本实验要求,用50mL0.5mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量计算中和热.下列说法正确的是( )| A、实验过程中没有热量损失 |
| B、图中实验装置缺少环形玻璃搅拌棒 |
| C、烧杯间填满碎泡沫塑料的作用是固定小烧杯 |
| D、酸或碱的物质的量越大,所测中和热的数值越大 |



 )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下: ;
;