题目内容
10.实验室有一包暗红色粉末样品可能是MgCO3、Fe2O3和FeO的混合物.经测定后,结论是不存在FeO.I.某学生想自己设计实验方案,以证明样品中确实没有FeO.除样品外,实验室只提供以下试剂:KMnO4溶液、稀盐酸、稀硫酸、KSCN溶液、NaOH溶液,请你描述实验操作的步骤、实验现象和结论:取少量样品溶于试管中,配成溶液后,再滴入几滴稀硫酸和几滴KMnO4溶液,只要溶液不褪色或不变浅,即说明样品中无FeO.
Ⅱ.测定混合物中Fe2O3的含量
实验室可用多种方法测定上述样品中Fe2O3的质量分数,某同学称取a g样品用下图所示装置测定Fe2O3的质量分数.

请回答下列问题:
(1)装置B中盛放样品的仪器名称是锥形瓶,A中的试剂是氢氧化钠溶液.
(2)装置B中反应的离子方程式为MgCO3+2H+=Mg2++CO2↑+H2O,Fe2O3+6H+=2Fe3++3H2O.
(3)实验过程中需要持续通入空气,其作用除可以起到“搅拌”B中反应物以实现充分反应外,还有一个重要作用是将反应产生的CO2气体尽可能彻底的赶入装置C中,使之完全被Ba(OH)2溶液吸收.
(4)若后续实验测得C中沉淀的质量为b g,则Fe2O3的质量分数为$\frac{197a-84b}{197a}$×100%.测C中沉淀的操作是过滤、洗涤、干燥、称量.
(5)有同学认为将装置C与D交换,测出装置D在吸收反应产生的气体前后的质量差,同样可以测得Fe2O3的质量分数.请你对此方案作出评价:不能,因为生成的二氧化碳气体中含有水蒸气,通过装置D会被吸收,装置D增重为二氧化碳和水蒸气的质量.
分析 Ⅰ.若Fe2O3中含有FeO,利用稀酸(非氧化性)溶解后生成的亚铁离子,则具有还原性,而给出的试剂中KMnO4溶液具有强氧化性,可利用KMnO4溶液褪色来证明;根据检验方法写出实验操作时的步骤、实验现象和结论;
Ⅱ.(1)样品可能是MgCO3、Fe2O3固体,放入锥形瓶中,通过分液漏斗加入盐酸发生反应,和碳酸镁反应生成二氧化碳气体,A中是氢氧化钠溶液,通过装置A通入空气除去二氧化碳后把装置中的空气赶净,反应后把生成的二氧化碳全部赶入装置C吸收;
(2)装置B中反应是MgCO3、Fe2O3固体和盐酸反应,碳酸镁和盐酸反应生成二氧化碳气体,氧化铁和盐酸反应生成氯化铁和水;
(3)根据通入空气还可以将碳酸钙与盐酸反应生成的二氧化碳驱赶到装置B中分析;
(4)若后续实验测得C中沉淀的质量为b g,为碳酸钡沉淀,依据碳元素守恒计算碳酸镁的质量,得到原样品中氧化铁质量得到质量分数;溶液中沉淀通过过滤得到沉淀、洗涤、干燥、称量.
解答 解:Ⅰ.若Fe2O3中含有FeO,利用稀酸(非氧化性)溶解后生成的亚铁离子,则具有还原性,而给出的试剂中KMnO4溶液具有强氧化性,可使KMnO4溶液褪色,
则选择试剂为稀硫酸、KMnO4溶液;实验操作时的步骤、实验现象和结论为:取少量样品溶于试管中,配成溶液后,再滴入几滴稀硫酸和几滴KMnO4溶液,只要溶液不褪色或不变浅,即说明样品中无FeO,
故答案为:取少量样品溶于试管中,配成溶液后,再滴入几滴稀硫酸和几滴KMnO4溶液,只要溶液不褪色或不变浅,即说明样品中无FeO;
Ⅱ.(1)样品可能是MgCO3、Fe2O3固体,放入锥形瓶中,通过分液漏斗加入盐酸发生反应,和碳酸镁反应生成二氧化碳气体,A中是氢氧化钠溶液,通过装置A通入空气除去二氧化碳后把装置中的空气赶净,反应后把生成的二氧化碳全部赶入装置C吸收,
故答案为:锥形瓶;氢氧化钠溶液;
(2)装置B中反应是MgCO3、Fe2O3固体和盐酸反应,碳酸镁和盐酸反应生成二氧化碳气体,反应的离子方程式为:MgCO3+2H+=Mg2++CO2↑+H2O,氧化铁和盐酸反应生成氯化铁和水,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,
故答案为:MgCO3+2H+=Mg2++CO2↑+H2O,Fe2O3+6H+=2Fe3++3H2O;
(3)实验过程中需要持续通入空气,其作用除可以起到“搅拌”B中反应物达到充分反应外,还可以使反应生成的二氧化碳尽可能彻底的赶入装置A中,使反应生成的二氧化碳能够被氢氧化钡溶液完全吸收,
故答案为:将反应产生的CO2气体尽可能彻底的赶入装置C中,使之完全被Ba(OH)2溶液吸收;
(4)若后续实验测得C中沉淀的质量为b g,为碳酸钡沉淀物质的量n(BaCO3)=$\frac{bg}{197g/mol}$,依据碳元素守恒计算碳酸镁的质量=$\frac{bg}{197g/mol}$×84g/mol=$\frac{84b}{197}$g,得到原样品中氧化铁质量得到质量分数=$\frac{ag-\frac{84b}{197}g}{ag}$×100%=$\frac{197a-84b}{197a}$×100%,溶液中沉淀通过过滤得到沉淀、洗涤、干燥、称量,
故答案为:$\frac{197a-84b}{197a}$×100%;过滤;洗涤;
(5)将装置C与D交换,测出装置D在吸收反应产生的气体前后的质量差为二氧化碳和水蒸气的质量,不能测得Fe2O3的质量分数,
故答案为:不能,因为生成的二氧化碳气体中含有水蒸气,通过装置D会被吸收,装置D增重为二氧化碳和水蒸气的质量.
点评 本题考查了实验探究物质组成和含量的实验过程分析判断,主要是混合物反应后生成气体的质量测定方法,掌握基础是解题关键,题目难度中等.

| A. | 2g氢气所含原子数目为NA | |
| B. | 1.7g NH3中含N-H键数目为0.1NA | |
| C. | 标准状况下,22.4L单质溴所含有的原子数目为2NA | |
| D. | 1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子 |
| A. | NO2、SO2都是酸性氧化物,都能使酸性高锰酸钾溶液褪色 | |
| B. | MgO、Al2O3都是高熔点离子化合物,都能用作耐热材料 | |
| C. | CO2与SiO2化学式相似,则CO2与SiO2的物理性质也相似 | |
| D. | CuO、Fe2O3都是不溶于水的碱性氧化物,都是黑色粉末 |
| A. | 该条件下反应的平衡常数为1.6×103 | |
| B. | 通常情况下,该反应一定能自发进行 | |
| C. | 题给条件下,SO2的转化率是80% | |
| D. | 当体系中SO2和SO3的速率之比是1:1时,则该反应达到化学平衡状态 |
| A. | Na2O2是淡黄色固体,久置于空气中变成Na2O | |
| B. | Na2O2与水的反应中,Na2O2只作氧化剂 | |
| C. | 用0.1mol Na2O2与足量水反应转移的电子的物质的量为0.2mol | |
| D. | Na2O2放入饱和NaOH溶液中,放出大量的O2,并有白色固体析出 |
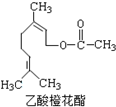 某食用香料乙酸橙花酯的结构简式如图所示,关于该有机物的下列叙述中正确的是( )
某食用香料乙酸橙花酯的结构简式如图所示,关于该有机物的下列叙述中正确的是( )①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③它的同分异构体中有芳香族化合物
④1mol该有机物水解时只能消耗1molNaOH
⑤1mol该有机物在一定条件下能和3mol H2反应.
| A. | ①②③ | B. | ①②④ | C. | ①②⑤ | D. | ①②③④ |
| A. | 开发生物质能替代化石燃料 | B. | 向高空排放金属冶炼产生的粉尘 | ||
| C. | 用催化转化技术处理汽车尾气 | D. | 大力推广生产和使用无氟冰箱 |
| A. | MgO | B. | Al2O3 | C. | SiO2 | D. | Cl2 |