题目内容
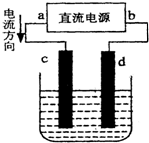
氯是一种富集在海水中的元素.通常实验室采用MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O方法制取少量氯气.如图是一套制取并验证氯气不跟化学性质的实验装置:
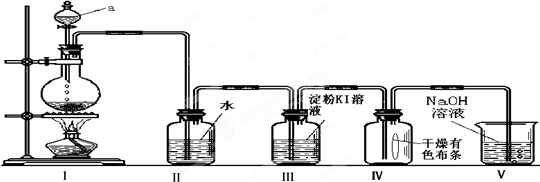
回答下列问题:
(1)装置Ⅰ中,仪器a的名称叫 .(选择序号填空)
①分液漏斗 ②长颈漏斗 ③容量瓶 ④蒸馏烧瓶
(2)当氯气气流通过一段时间后,装置Ⅱ中溶液的pH会 (填“变大”“变小”“不变”)
(3)当有少量氯气气流通过后,装置Ⅲ中看到的现象为 .
(4)当有少量氯气气流持续通过时,装置Ⅳ中干燥的有色布条 (填“能”或“不能”)褪色.
(5)装置Ⅴ的作用是 .

回答下列问题:
(1)装置Ⅰ中,仪器a的名称叫
①分液漏斗 ②长颈漏斗 ③容量瓶 ④蒸馏烧瓶
(2)当氯气气流通过一段时间后,装置Ⅱ中溶液的pH会
(3)当有少量氯气气流通过后,装置Ⅲ中看到的现象为
(4)当有少量氯气气流持续通过时,装置Ⅳ中干燥的有色布条
(5)装置Ⅴ的作用是
考点:氯气的实验室制法,氯、溴、碘的性质实验
专题:实验题
分析:(1)熟悉常见仪器,了解名称;
(2)氯气与水反应生成盐酸和次氯酸,盐酸溶液中存在氢离子,溶液酸性增强;
(3)氯气具有强的氧化性,能够氧化碘化钾生成单质碘,碘与淀粉变蓝色;
(4)氯气与水反应生成次氯酸,次氯酸具有漂白性;
(5)氯气有毒,不能直接排放的空气中,氯气能够与氢氧化钠反应,可以用氢氧化钠吸收氯气.
(2)氯气与水反应生成盐酸和次氯酸,盐酸溶液中存在氢离子,溶液酸性增强;
(3)氯气具有强的氧化性,能够氧化碘化钾生成单质碘,碘与淀粉变蓝色;
(4)氯气与水反应生成次氯酸,次氯酸具有漂白性;
(5)氯气有毒,不能直接排放的空气中,氯气能够与氢氧化钠反应,可以用氢氧化钠吸收氯气.
解答:
解:(1)装置Ⅰ中,仪器a的名称叫分液漏斗;
故答案为:分液漏斗;
(2)氯气与水反应生成盐酸和次氯酸,氯化氢电离产生氢离子,溶液酸性增强,pH减小;
故答案为:变小;
(3)氯气具有强的氧化性,能够氧化碘化钾生成单质碘,碘与淀粉变蓝色;
故答案为:溶液变蓝;
(4)氯气与水反应生成次氯酸,次氯酸具有漂白性,能够使有色布条褪色;
故答案为:能;
(5)氯气有毒,不能直接排放的空气中,氯气能够与氢氧化钠反应,可以用氢氧化钠吸收氯气;
故答案为:吸收尾气.
故答案为:分液漏斗;
(2)氯气与水反应生成盐酸和次氯酸,氯化氢电离产生氢离子,溶液酸性增强,pH减小;
故答案为:变小;
(3)氯气具有强的氧化性,能够氧化碘化钾生成单质碘,碘与淀粉变蓝色;
故答案为:溶液变蓝;
(4)氯气与水反应生成次氯酸,次氯酸具有漂白性,能够使有色布条褪色;
故答案为:能;
(5)氯气有毒,不能直接排放的空气中,氯气能够与氢氧化钠反应,可以用氢氧化钠吸收氯气;
故答案为:吸收尾气.
点评:本题考查了氯气的制备和性质的检验,题目难度不大,熟悉反应的原理、明确氯、溴、碘的性质是解题关键,注意氯水的成分及性质.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、常温常压下,4.6gNO2和N2O4混合物中含有的原子数为0.3NA |
| B、1mo1?L-1的A1C13溶液中,C1-离子的数目为3NA |
| C、标准状况下,22.4LCl2与足量NaOH溶液反应转移的电子数为2NA |
| D、标准状况下,22.4L SO3所含的分子数目为NA |
 有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同.
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同. (Ⅰ)2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.请回答下列问题:
(Ⅰ)2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.请回答下列问题:
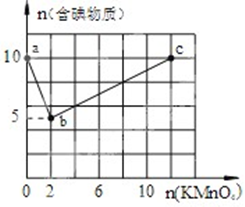 实验一:向含10mol KI的硫酸溶液中逐滴加入高锰酸钾溶液.整个过程中含碘物质与加入高锰酸钾的物质的量的关系如图,已知酸性条件下MnO4-转变为Mn2+.
实验一:向含10mol KI的硫酸溶液中逐滴加入高锰酸钾溶液.整个过程中含碘物质与加入高锰酸钾的物质的量的关系如图,已知酸性条件下MnO4-转变为Mn2+.