题目内容
13.下列数值等于阿伏加德罗常数值的是( )| A. | 1 mol羟基(-OH)中所含共价键数 | |
| B. | 1molHCl与KClO3反应生成0.5molCl2转移的电子数 | |
| C. | 1.8 g H2O中所含有的质子数、电子数、中子数 | |
| D. | 常温常压下,22.4LNO和CO混合气体中的O原子个数 |
分析 A.羟基中含有1个共价键,1mol羟基中含有1mol共价键;
B.反应中KClO3中Cl元素化合价由+5价降低为Cl2中0价,Cl2是还原产物,而HCl中Cl元素化合价由-1价升高为Cl2中0价,Cl2也是氧化产物,据此计算出生成0.5mol氯气转移电子数;
C.水分子中含有的质子数、电子数为10,而含有的中子数为8;
D.常温常压下,不是标准状况下.
解答 解:A.1 mol羟基(-OH)中含有1mol共价键,所含共价键数NA,故A正确;
B.KClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$KCl+3Cl2↑+3H2O,反应中KClO3中Cl元素化合价由+5价降低为Cl2中0价,而HCl中Cl元素化合价由-1价升高为Cl2中0价,由方程式可知,生成0.5mol Cl2需要KClO3的物质的量为1mol×$\frac{0.5mol}{3mol}$=$\frac{1}{6}$mol,则转移电子为$\frac{1}{6}$mol×5=$\frac{5}{6}$mol,不是1mol,故B错误;
C.1.8g水的物质的量为0.1mol,0.1mol水分子中含有1mol质子、1mol电子,而含有的中子为0.8mol,故C错误;
D.不是标准状况下,不能使用标准状况下的气体摩尔体积计算混合气体的物质的量,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确阿伏伽德罗常数的概念及计算方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.现有MgCl2、AlCl3、CuCl2、FeCl3、FeCl2、NH4Cl六种溶液,如果只用一种试剂把它们区分开来,这种试剂是( )
| A. | 氨水 | B. | AgNO3 | C. | NaOH | D. | BaCl2 |
4.用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 78克苯中含有碳碳双键的数目为3NA | |
| B. | 1molCl2与足量的铁反应,转移的电子数为3NA | |
| C. | 标准状况下,2.24LCCl4所含分子数为0.1NA | |
| D. | 0.2mol金属钠与足量的O2反应,产物中离子数为0.3 NA |
1.W、X、Y、Z均为短周期主族元素,原子序数依次增加,且互不同族,其中只有两种为金属元素,W原子的最外层电子数与次外层电子数相等,W与Z、X与Y这两对原子的最外层电子数之和均为9,单质X与Z都可与NaOH溶液反应.下列说法正确的是( )
| A. | 原子半径:Z>Y>X | |
| B. | 最高价氧化物的水化物的酸性:Y>Z | |
| C. | 化合物WZ2中各原子均满足8电子的稳定结构 | |
| D. | Y、Z均能与碳元素形成共价化合物 |
8.X、Y、Z、W为原子序数依次增大的四种短周期元素,X的一种同素异形体具有杀菌、消毒能力,Y单质与X单质在不同条件下反应会生成2种不同化合物,Z简单离子半径是同周期元素简单离子中最小的,H2在W单质中燃烧产生苍白色火焰.下列说法正确的是( )
| A. | 简单离子半径:W>Y>X | |
| B. | Z与W形成的化合物在熔融状态下能导电 | |
| C. | 电解Y、W形成的化合物,无论是熔融状态下还是水溶液中,都能得到单质W | |
| D. | 单质X与单质Y加热条件下能生成白色固体 |
18.苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理:
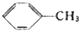 $→_{△}^{KMnO_{4}}$
$→_{△}^{KMnO_{4}}$ $\stackrel{HCl}{→}$
$\stackrel{HCl}{→}$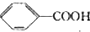
(一)制备苯甲酸
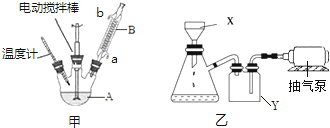
如甲图所示组装反应装置(部分装置未画出),向A中依次加入100mL水、8.5g高锰酸钾、2.7mL甲苯.相关数据如下表:
(1)装置B的作用是冷凝回流,A装置常见的规格有50mL、100mL、250mL、500mL、1000mL,最适合本实验选择的规格是250mL.
(二)分离提纯
停止加热后,按如下流程分离出苯甲酸和回收未反应的甲苯:
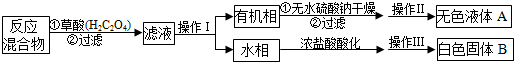
(2)操作I的名称是分液,操作Ⅱ时,应将有机相盛放在蒸馏烧瓶(填仪器名称)中.
(3)操作Ⅲ包括蒸发浓缩、冷却结晶、抽滤.抽滤装置为上图中的乙装置,将物质放在X装置(布氏漏斗)中,打开抽气泵,一段时间后X装置中剩余的是白色固体B,抽滤装置可以加快过滤速率,其工作原理是抽出装置中的空气,形成压强差,使过滤加快.
(三)提纯和纯度的测定
(4)为了进一步提纯苯甲酸,最好采用的方法是B(填编号).
A.溶于水后再过滤 B.加热升华 C.用乙醇洗涤 D.用甲苯萃取后再分液
(5)称取1.00g样品,加0.50mol/L的NaOH溶液,恰好完全反应时,消耗NaOH 溶液的体积为16.00mL,则产品的纯度为97.6%.
(四)性质验证
(6)设计实验证明苯甲酸是一种比碳酸酸性强的弱酸,简要说明实验操作,现象 和结论.
供选择的试剂:苯甲酸、苯甲酸钾溶液、饱和碳酸钠溶液、氢氧化钠溶液、稀盐酸、酚酞试液、石蕊试液.
 $→_{△}^{KMnO_{4}}$
$→_{△}^{KMnO_{4}}$ $\stackrel{HCl}{→}$
$\stackrel{HCl}{→}$
(一)制备苯甲酸

如甲图所示组装反应装置(部分装置未画出),向A中依次加入100mL水、8.5g高锰酸钾、2.7mL甲苯.相关数据如下表:
| 名称 | 相对分子质量 | 性状 | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 92 | 无色液体、易燃、易挥发 | -95 | 110.6 | 不溶 | 互溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 112.4(100℃升华) | 248 | 微溶 | 易溶 |
(二)分离提纯
停止加热后,按如下流程分离出苯甲酸和回收未反应的甲苯:

(2)操作I的名称是分液,操作Ⅱ时,应将有机相盛放在蒸馏烧瓶(填仪器名称)中.
(3)操作Ⅲ包括蒸发浓缩、冷却结晶、抽滤.抽滤装置为上图中的乙装置,将物质放在X装置(布氏漏斗)中,打开抽气泵,一段时间后X装置中剩余的是白色固体B,抽滤装置可以加快过滤速率,其工作原理是抽出装置中的空气,形成压强差,使过滤加快.
(三)提纯和纯度的测定
(4)为了进一步提纯苯甲酸,最好采用的方法是B(填编号).
A.溶于水后再过滤 B.加热升华 C.用乙醇洗涤 D.用甲苯萃取后再分液
(5)称取1.00g样品,加0.50mol/L的NaOH溶液,恰好完全反应时,消耗NaOH 溶液的体积为16.00mL,则产品的纯度为97.6%.
(四)性质验证
(6)设计实验证明苯甲酸是一种比碳酸酸性强的弱酸,简要说明实验操作,现象 和结论.
供选择的试剂:苯甲酸、苯甲酸钾溶液、饱和碳酸钠溶液、氢氧化钠溶液、稀盐酸、酚酞试液、石蕊试液.
5.下列说法中,不正确的是( )
| A | B | C | D |
 |  |  | 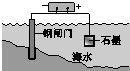 |
| 钢铁表面水膜的酸性很弱或呈中性,发生吸氧腐蚀 | 钢铁表面水膜的酸 性较强,发生析氢 腐蚀 | 将锌板换成铜板对 钢闸门保护效果更好 | 钢闸门作为阴极而受到保护 |
| A. | A | B. | B | C. | C | D. | D |
2.下列叙述中,不能说明X元素比Y元素的非金属性强的是( )
| A. | 与H2化合时,X单质比Y单质容易 | |
| B. | X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 | |
| C. | X原子的原子序数比Y原子的原子序数大 | |
| D. | X单质可以把Y从其氢化物中置换出来 |
6.一定温度下,可逆反应A2(g)+B2(g)?2AB(g)达到平衡状态的标志是( )
| A. | 单位时间内生成 n mol A2,同时生成 n mol AB | |
| B. | 体系内的总压不随时间变化 | |
| C. | 单位时间内生成2n mol AB的同时生成n mol B2 | |
| D. | 单位时间内生成 n mol A2的同时,生成n mol B2 |