题目内容
5.下列实验操作与实验目的或结论一致的是( )| 选项 | 实验操作及现象 | 实验结论 |
| A | 用pH计测得次氯酸钠溶液的pH>7 | HClO是弱酸 |
| B | 向10mL0.1 mol/L NaOH溶液中加入1mL 0.1mol/LMgCl2溶液,然后再向混合溶液中 滴加CuCl2溶液,产生蓝色沉淀 | 溶度积:Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| C | 在淀粉溶液中加入稀硫酸,水浴加热,一段 时间后,滴入几滴碘水,溶液变为蓝色 | 淀粉没有水解 |
| D | 在未知溶液中滴加BaCl2溶液出现白色沉淀, 加稀硝酸,沉淀不溶解 | 该未知溶液中存在SO42-或SO32- |
| A. | A | B. | B | C. | C | D. | D |
分析 A.次氯酸钠溶液的pH>7,为强碱弱酸盐溶液;
B.NaOH过量,为沉淀的生成;
C.水解一定时间,可能部分水解;
D.白色沉淀为硫酸钡或AgCl.
解答 解:A.次氯酸钠溶液的pH>7,为强碱弱酸盐溶液,则HClO为弱酸,故A正确;
B.NaOH过量,为沉淀的生成,不发生沉淀的转化,不能比较Ksp[Mg(OH)2]、Ksp[Cu(OH)2],故B错误;
C.水解一定时间,可能部分水解,没有检验葡萄糖,不能确定水解程度,故C错误;
D.白色沉淀为硫酸钡或AgCl,则原溶液中可能含银离子,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高考常见题型,侧重于学生的分析能力、实验能力的考查,把握反应原理、实验评价技能为解答该类题目的关键,注意实验现象与结论的关系,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.A、B、D、E、G、J六种短周期主族元素,原子半径依次减小.A、E、J位于相邻的不同周期,有机化合物均含有E元素.
(1)常见发酵粉、加碘盐、味精及某些食品防腐剂的主要成分都含有金属元素A的离子.A离子的结构示意图为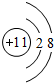 .
.
(2)写出E2J4与水反应的化学方程式CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH;其反应类型为加成反应.
(3)利用右图装置设计一简单实验证明元素非金属性D>B.甲中应盛放某种弱电解质的溶液,其溶质的化学式为H2S,所通入气体与乙中某强电解质溶液反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(4)元素D的最高价氧化物为无色液体,0.20mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量,该反应的热化学方程式为Cl2O7(l)+H2O(l)=HClO4(aq)△H=-QkJ/mol.
(5)G的最简单氢化物溶于水得溶液X,D的氢化物溶于水得溶液Y.常温下,将X、Y等体积混合,两种溶液的浓度和混合后所得溶液的pH,如下表:
①组混合溶液中由水电离出的c(H+)=10-5mol•L-1.
②组混合溶液中各离子浓度由大到小的顺序是c(NH4+)>c(Cl-)>c(OH-)>c(H+).

(1)常见发酵粉、加碘盐、味精及某些食品防腐剂的主要成分都含有金属元素A的离子.A离子的结构示意图为
 .
.(2)写出E2J4与水反应的化学方程式CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH;其反应类型为加成反应.
(3)利用右图装置设计一简单实验证明元素非金属性D>B.甲中应盛放某种弱电解质的溶液,其溶质的化学式为H2S,所通入气体与乙中某强电解质溶液反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(4)元素D的最高价氧化物为无色液体,0.20mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量,该反应的热化学方程式为Cl2O7(l)+H2O(l)=HClO4(aq)△H=-QkJ/mol.
(5)G的最简单氢化物溶于水得溶液X,D的氢化物溶于水得溶液Y.常温下,将X、Y等体积混合,两种溶液的浓度和混合后所得溶液的pH,如下表:
| 实验编号 | X物质的量浓度(mol•L-1) | Y物质的量浓度(mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | 0.2 | 0.1 | pH>7 |
②组混合溶液中各离子浓度由大到小的顺序是c(NH4+)>c(Cl-)>c(OH-)>c(H+).
16.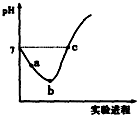 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验进程中可用pH试纸测定溶液的pH | |
| B. | a点的溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-) | |
| C. | 由a点到b点的过程中,溶液中C(H+):C(ClO-)减小 | |
| D. | c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) |
13.一种新型燃料电池,它是用两根惰性金属做电极插入KOH溶液中,然后向两极上分别通入甲烷和氧气,发生的电极反应为:X极:CH4+10OH--8e-═CO32-+7H2O; Y极:4H2O+2O2+8e-═8OH- 关于此燃料电池的下列说法中错误的是( )
| A. | X极为负极,Y极为正极 | |
| B. | 工作一段时间后,KOH的物质的量不变 | |
| C. | 电池工作时甲烷一极附近溶液的pH减小 | |
| D. | 该在标准状况下通入5.6 L O2完全反应,则有1.0mol电子发生转移 |
20.碳及其化合物在自然界中和人类活动中发挥着重要的作用.回答下列问题:
(1)已知常温下,几种弱酸的电离常数如表:
①等物质的量浓度的CH3COONa、NaCN、Na2CO3三种溶液的pH分别为pH1、pH2、pH3,则三者由大到小的顺序为pH3>pH2>pH1
②0.4mol•L-1的CH3COOH溶液与0.2mol•L-1的NaOH溶液等体积混合后,所得溶液中c(H+)>c(OH-)(填“>”“<”或“=”,下同)c(CH3COOH)<c(CH3COO-)
(2)工业生产中用可溶性的碳酸盐浸取石膏固体,写出浸取过程中发生反应的离子方程式:CaSO4+CO32-=CaCO3+SO42-;已知常温时${K}_{sp}(CaC{O}_{3})=2.80×1{0}^{-9}$,${K}_{sp}(CaS{O}_{4})=4.9×1{0}^{-5}$,则此温度下该离子反应的平衡常数K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$
(3)雾霾袭城的日子越来越多,其中对雾霾“贡献”较大的物质之一是氮氧化物,CH4催化还原可消除氮氧化物的污染. 已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
现采集NO2与NO的体积比为1:3的样品,用标准状况下22.4L的CH4处理该样品,恰好完全反应(已知生成物全部为气态)并放出1042.8kJ的热量,则△H2=-1160kJ/mol.
(1)已知常温下,几种弱酸的电离常数如表:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
②0.4mol•L-1的CH3COOH溶液与0.2mol•L-1的NaOH溶液等体积混合后,所得溶液中c(H+)>c(OH-)(填“>”“<”或“=”,下同)c(CH3COOH)<c(CH3COO-)
(2)工业生产中用可溶性的碳酸盐浸取石膏固体,写出浸取过程中发生反应的离子方程式:CaSO4+CO32-=CaCO3+SO42-;已知常温时${K}_{sp}(CaC{O}_{3})=2.80×1{0}^{-9}$,${K}_{sp}(CaS{O}_{4})=4.9×1{0}^{-5}$,则此温度下该离子反应的平衡常数K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$
(3)雾霾袭城的日子越来越多,其中对雾霾“贡献”较大的物质之一是氮氧化物,CH4催化还原可消除氮氧化物的污染. 已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
现采集NO2与NO的体积比为1:3的样品,用标准状况下22.4L的CH4处理该样品,恰好完全反应(已知生成物全部为气态)并放出1042.8kJ的热量,则△H2=-1160kJ/mol.
10.下列说法正确的是( )
| A. | 我国2015年玉月1日正式实施的《环境保护法》被称为“史上最严”环保法,为保护好环境,工业生产应从源头上减少或尽量消除生产对环境的污染 | |
| B. | 在某爆炸事故救援现场,消防员发现存放金属钠、电石、甲苯二异氰酸酯 等化学品的仓库起火,应立即用泡沫灭火器将火扑灭 | |
| C. | 世界卫生组织认为青蒿素(结构如右图所示)联合疗法是当下治疗疟疾最 有效的手段,已经拯救了上百万生命,靑蒿素属于烃类物质 | |
| D. | 某品牌化妆品在广告中反复强调:“十年专注自然护肤”,该产品中不含任何化学成分 |
17.化学是材料科学发展的基础.下列说法正确的是( )
| A. | 可用作荧光灯内壁保护层的氧化铝纳米材料属于胶体 | |
| B. | 高分子材料可能导电,如聚乙炔 | |
| C. | 钢化玻璃、有机玻璃、防弹玻璃均属于硅酸盐材料 | |
| D. | 人造刚玉的主要成分是MgO,熔点很高,可用作高级耐火材料 |
14.某学习小组在实验室研究SO2与Ba(NO3)2溶液的反应:
实验:向盛有2mL 0.1mol/L Ba(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色.
探究1:白色沉淀产生的原因.
(1)白色沉淀是BaSO4.
(2)分析白色沉淀产生的原因,甲同学认为是NO3-氧化了SO2,乙同学认为是溶液中溶解的O2氧化了SO2.
①支持甲同学观点的实验证据是液面上方略显浅棕色.
②依据甲的推断,请写出Ba(NO3)2溶液与SO2反应的离子方程式3Ba2++2NO3-+3SO2+2H2O=3BaSO4↓+2NO+4H+.
③乙同学通过下列实验证明了自己的推测正确,请完成实验方案:
探究2:在氧化SO2的过程中,NO3-和O2哪种微粒起到了主要作用.
(3)图1,在无氧条件下,BaCl2溶液pH下降的原因是SO2+H2O?H2SO3,H2SO3?HSO3-+H+.
(4)图2,BaCl2溶液中发生反应的离子方程式为2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+.
(5)依据上述图象你得出的结论是在氧化SO2的过程中,O2起了主要作用.
实验:向盛有2mL 0.1mol/L Ba(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色.
探究1:白色沉淀产生的原因.
(1)白色沉淀是BaSO4.
(2)分析白色沉淀产生的原因,甲同学认为是NO3-氧化了SO2,乙同学认为是溶液中溶解的O2氧化了SO2.
①支持甲同学观点的实验证据是液面上方略显浅棕色.
②依据甲的推断,请写出Ba(NO3)2溶液与SO2反应的离子方程式3Ba2++2NO3-+3SO2+2H2O=3BaSO4↓+2NO+4H+.
③乙同学通过下列实验证明了自己的推测正确,请完成实验方案:
| 实验操作 | 实验现象 |
| 向2mL 0.1mol/LBaCl2 溶液(填化学式)中通入SO2 | 试管内有白色沉淀产生 |
| 实验操作 | 实验数据 |
| 向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,用pH传感器测定溶液pH随时间(t)的变化曲线 | 图1:向BaCl2(无氧)溶液中通入SO2 |
| 向烧杯中分别加入25mL 0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2,用pH传感器分别测定溶液pH随时间(t)变化的曲线. | 图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2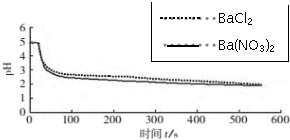 |
(4)图2,BaCl2溶液中发生反应的离子方程式为2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+.
(5)依据上述图象你得出的结论是在氧化SO2的过程中,O2起了主要作用.

 ;
;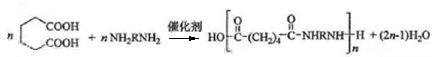 ;
; ;
; .
.