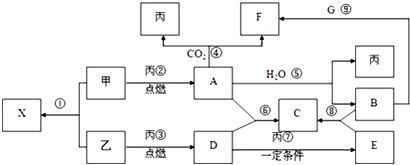
题目内容
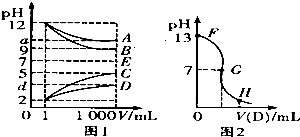 物质A-E都是由下表中的离子组成的,常温下各物质从l mL稀释到1000mL,pH的变化如图l所示,其中A与D反应得到E.请回答:
物质A-E都是由下表中的离子组成的,常温下各物质从l mL稀释到1000mL,pH的变化如图l所示,其中A与D反应得到E.请回答:| 阳离子 |
| ||
| 阴离子 | OH-、CH3COO-、Cl- |
(2)图l中a>9的理由是
(3)另取浓度为C1的B溶液25ml,向其中逐滴滴加0.2mol/L的D溶液,滴定过程中溶液pH的变化曲线如图2所示.
①C1为
②G点溶液呈中性,则加入D溶液的体积V
③常温下B、C溶液的pH分别是a、b且a+b=13,则将B、C混合恰好完全反应时所消耗B、C溶液的体积比VB:VC=
考点:常见阳离子的检验,酸碱混合时的定性判断及有关ph的计算,常见阴离子的检验
专题:物质检验鉴别题,电离平衡与溶液的pH专题
分析:根据图象知A、B是碱,C、D是酸,稀释后A、D的pH变化小于3,B、C的pH变化等于3,则A是弱碱、B是强碱,C是强酸,D是弱酸,根据离子知,A是氨水、B是氢氧化钠、C是盐酸、D是醋酸,
(1)物质B为氢氧化钠,化学式为NaOH;
(2)一水合氨是弱电解质,氨水溶液中存在电离平衡;
(3)①c(NaOH)=
;
②醋酸钠是强碱弱酸盐,要使其溶液呈中性,则醋酸应该稍微过量;
③BC分别是氢氧化钠与盐酸,依据题意,恰好完全反应,即n(H+)=n(OH-),即有:VB?
=VC.10-b,即
=
=
=
.
(1)物质B为氢氧化钠,化学式为NaOH;
(2)一水合氨是弱电解质,氨水溶液中存在电离平衡;
(3)①c(NaOH)=
| 10-14 |
| 10-pH |
②醋酸钠是强碱弱酸盐,要使其溶液呈中性,则醋酸应该稍微过量;
③BC分别是氢氧化钠与盐酸,依据题意,恰好完全反应,即n(H+)=n(OH-),即有:VB?
| 10-14 |
| 10-a |
| VB |
| VC |
| 10-(a+b) |
| 10-14 |
| 10-13 |
| 10-14 |
| 10 |
| 1 |
解答:
解:(1)根据图象知A、B是碱,C、D是酸,稀释后A、D的pH变化小于3,B、C的pH变化等于3,则A是弱碱、B是强碱,C是强酸,D是弱酸,根据离子知,A是氨水、B是氢氧化钠、C是盐酸、D是醋酸,故答案为:NaOH;CH3COOH;
(2)氨水中存在一水合氨的电离平衡,加水稀释促进一水合氨电离,导致溶液中氢氧根离子浓度大于原来的千分之一,
故答案为:A是氨水,稀释平衡向电离的方向移动,溶液中c(OH-)没有下降到原来的千分之一;
(3)①c(NaOH)=
=
mol/L=0.1mol/L,故答案为:0.1mol/L;
②醋酸钠是强碱弱酸盐,其溶液呈碱性,要使醋酸和氢氧化钠混合溶液呈中性,则醋酸应该稍微过量,所以V>12.5mL,故答案为:>;
③BC分别是氢氧化钠与盐酸,依据题意,恰好完全反应,即n(H+)=n(OH-),即有:VB?
=VC.10-b,即
=
=
=
,故答案为:10:1.
(2)氨水中存在一水合氨的电离平衡,加水稀释促进一水合氨电离,导致溶液中氢氧根离子浓度大于原来的千分之一,
故答案为:A是氨水,稀释平衡向电离的方向移动,溶液中c(OH-)没有下降到原来的千分之一;
(3)①c(NaOH)=
| 10-14 |
| 10-pH |
| 10-14 |
| 10-13 |
②醋酸钠是强碱弱酸盐,其溶液呈碱性,要使醋酸和氢氧化钠混合溶液呈中性,则醋酸应该稍微过量,所以V>12.5mL,故答案为:>;
③BC分别是氢氧化钠与盐酸,依据题意,恰好完全反应,即n(H+)=n(OH-),即有:VB?
| 10-14 |
| 10-a |
| VB |
| VC |
| 10-(a+b) |
| 10-14 |
| 10-13 |
| 10-14 |
| 10 |
| 1 |
点评:本题考查了物质的推断,涉及弱电解质的电离、酸碱混合溶液定性判断,明确弱电解质的电离特点推断物质,再结合弱电解质的性质来分析解答,题目难度中等.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
下列实验操作正确的是( )
A、 制氨气 |
B、 收集CO2或NO |
C、 配制稀硫酸 |
D、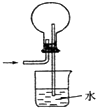 氨气的吸收 |
 I.科学家最近在-100℃的低温下合成了一种烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型.下列说法中错误的是
I.科学家最近在-100℃的低温下合成了一种烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型.下列说法中错误的是