题目内容
下面各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )


| A、①②③④⑤ |
| B、⑤①②③④ |
| C、⑤①③②④ |
| D、④⑤①③② |
考点:原电池和电解池的工作原理,金属的电化学腐蚀与防护
专题:电化学专题
分析:铁腐蚀快慢顺序是:作电解池阳极>原电池负极>化学腐蚀>作原电池正极>作电解池阴极,据此分析解答.
解答:
解:铁腐蚀快慢顺序是:作电解池阳极>原电池负极>化学腐蚀>作原电池正极>作电解池阴极,
①中铁的活动性大于Sn,所以铁作负极,加速被腐蚀;
②中锌的活动性大于Fe,所以锌作负极、铁作正极,被保护;
③中铁发生化学反应;
④中铁作阴极,被保护;
⑤中铁作阳极加速被腐蚀;
所以铁腐蚀快慢顺序是⑤①③②④,
故选C.
①中铁的活动性大于Sn,所以铁作负极,加速被腐蚀;
②中锌的活动性大于Fe,所以锌作负极、铁作正极,被保护;
③中铁发生化学反应;
④中铁作阴极,被保护;
⑤中铁作阳极加速被腐蚀;
所以铁腐蚀快慢顺序是⑤①③②④,
故选C.
点评:本题考查了金属腐蚀快慢判断,明确铁发生的腐蚀类型及作何种电极即可解答,利用金属腐蚀与防护,采取合适措施防止铁被腐蚀,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
 如图所示为鲁科版化学教科书(我们正在使用的教科书)必修1中“迁移应用”栏目的一个学习活动.下列关于a、b、c、d处所填内容及这幅图含义的描述中,不正确的是( )
如图所示为鲁科版化学教科书(我们正在使用的教科书)必修1中“迁移应用”栏目的一个学习活动.下列关于a、b、c、d处所填内容及这幅图含义的描述中,不正确的是( )| A、a=1.204×1024、b=6.02×1023、c=2、d=1 |
| B、6.02×1023个H2O水分子中含有1.204×1024个氢原子和6.02×1023个氧原子 |
| C、1mol H2O中含有2mol H和1mol O |
| D、对于同一微粒,其物质的量与微粒数间可通过阿伏加德罗常数实现相互换算 |
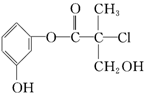 某有机物是药物生产的中间体,其结构简式如图.下列有关叙述正确的是( )
某有机物是药物生产的中间体,其结构简式如图.下列有关叙述正确的是( )| A、该有机物能与溴水发生加成反应 |
| B、该有机物与浓硫酸混合加热可发生消去反应 |
| C、1mol该有机物与足量NaOH溶液反应最多消耗3mol NaOH |
| D、该有机物经催化氧化后能发生银镜反应 |
下列电子排布中,原子处于激发状态的是( )
| A、1s22s2 |
| B、1s22s22p5 |
| C、1s22s22p63s23p63d54s1 |
| D、1s22s22p63s23p63d104s14p3 |
随着社会的发展,人们日益重视环境问题、节能减排,下列说法不正确的是( )
| A、绿色化学的核心是利用化学原理从源头上减少和消除工农业生产等对环境的污染 |
| B、“低碳生活”倡导生活中耗用能量尽量减少,从而减少CO2排放 |
| C、采用催化转换技术将汽车尾气中的NOx和CO转化为无毒气体 |
| D、大量进口国外电子垃圾,回收其中的贵重金属 |
下列关于胶体的叙述正确的是( )
| A、向1 mol?L-1氯化铁溶液中加入少量的NaOH溶液制取氢氧化铁胶体 |
| B、可以用丁达尔现象区别硫酸铜溶液和氢氧化铁胶体 |
| C、氢氧化铁胶体通电后氢氧化铁胶粒向正极移动 |
| D、由0.1mol氯化铁制取的氢氧化铁胶体中,氢氧化铁胶粒数目为0.1NA(设NA表示阿伏加德罗常数的值) |
用坩埚钳夹住一小块刚用酸充分处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落.下列关于上述实验现象的解释正确的是( )
| A、火焰温度太低不能使铝燃烧 |
| B、铝在空气中能很快形成氧化膜 |
| C、氧化铝的熔点比铝的熔点低 |
| D、用酸处理时未能将氧化铝溶解 |
下列变化属于氧化还原反应,但不属于四种基本反应类型的是( )
A、CO+CuO
| ||||
B、2Al+Fe2O3
| ||||
C、2O3
| ||||
| D、Cl2+2FeCl2═2FeCl3 |