题目内容
15.同温同压下,相同体积的氧气和氨气,可以肯定的是( )| A. | 质量相等 | B. | 物质的量相等 | ||
| C. | 都含有6.02×1023个分子 | D. | 电子数相等 |
分析 同温同压下,相同体积的氧气和氨气,Vm相同,则n相同,结合N=nNA、m=nM及分子构成计算.
解答 解:同温同压下,相同体积的氧气和氨气,Vm相同,则n相同,都含有6.02×1023个分子,因M不同,则质量不同,1个氧气分子含16个电子,1个氨气分子含10个电子,则物质的量相同时电子数不同,
故选BC.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的计算能力的考查,注意把握物质的量为中心的基本计算公式,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
5.下列说法正确的是( )
| A. | 硅在常温下可以和氢气发生反应 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量最高 | |
| C. | 硅和任何酸都不反应 | |
| D. | 硅在电子工业上是重要的半导体材料 |
6.下列反应的离子方程式书写正确的是( )
| A. | 用氨水吸收过量SO2气体:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| B. | FeI2溶液中通入C12至Fe2+恰好完全被氧化:2Fe2++C12═2Fe3++2C1- | |
| C. | NH4HCO3溶液与过量的NaOH溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 将1 mol•L-1 NaAlO2溶液和1.5 mol•L-1的HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O═5Al(OH)3↓+Al3+ |
3.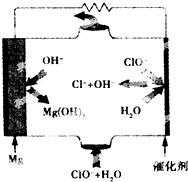 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )| A. | 该燃料电池中镁为负极,发生氧化反应 | |
| B. | 正极反应式为ClO-+H2O+2e-═Cl-+2OH- | |
| C. | 电池总反应式为Mg+ClO-+H2O═Mg(OH)2↓+Cl- | |
| D. | 放电过程中OH-移向正极 |
10.A、B是原子最外层电子数分别为1和6的两种短周期元素,如果由A、B两种元素组成的化合物,则化合物的化学式可能是( )
| A. | AB2 | B. | BA2 | C. | AB | D. | A2B2 |
7.结合化学与环境相关知识,下列有关说法正确的是( )
| A. | SO2、NO2、CO2均属于大气污染物 | |
| B. | 酸雨是pH小于5.6的降水 | |
| C. | CO2也会导致酸雨的形戒 | |
| D. | 大气中O2含量的增加会导致温室效应加剧 |
3.NA表示阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 5.6g铁粉与7.1g Cl2充分反应,转移电子数0.3NA | |
| B. | 1.7g羟基与1.6g甲烷分子所含电子数分别是0.9NA和NA | |
| C. | 3mol NO2与水充分反应时转移电子数2NA | |
| D. | 87g MnO2与含4NA HCl的浓盐酸加热反应,生成的氯气在标准状况下体积小于22.4L |