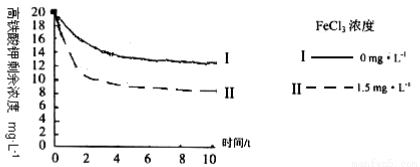
题目内容
3.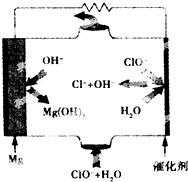 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )| A. | 该燃料电池中镁为负极,发生氧化反应 | |
| B. | 正极反应式为ClO-+H2O+2e-═Cl-+2OH- | |
| C. | 电池总反应式为Mg+ClO-+H2O═Mg(OH)2↓+Cl- | |
| D. | 放电过程中OH-移向正极 |
分析 该燃料电池中,镁易失电子作负极、次氯酸根离子得电子发生还原反应,负极电极反应式为Mg-2e-=Mg 2+,正极电极反应式为:ClO-+H2O+2e-=Cl-+2OH-,放电时,电解质溶液中阴离子向负极移动.
解答 解:A.镁失电子发生氧化反应而作负极,故A正确;
B.正极上双氧水得电子发生还原反应,电极反应式为ClO-+H2O+2e-═Cl-+2OH-,故B正确;
C.镁在负极上失电子生成镁离子,次氯酸根离子在正极上得电子和水生成氯离子和氢氧根离子,所以电池反应式为:Mg+ClO-+H2O=Mg(OH)2+Cl-,故C正确;
D.放电过程中氢氧根离子向负极移动,故D错误;
故选D.
点评 本题考查了原电池原理,明确正负极上发生的反应是解本题关键,再结合离子移动方向来分析解答,题目难度不大.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案
相关题目
13.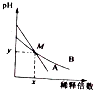 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示,下列说法正确的是( )
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示,下列说法正确的是( )
 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示,下列说法正确的是( )
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示,下列说法正确的是( )| A. | 稀释前,c(A)=10c(B) | |
| B. | 在M点,A、B两种碱溶液中阳离子的物质的量浓度相等 | |
| C. | 稀释前,A溶液中由水电离出的OH-的浓度大于10-7mol/L | |
| D. | 由图可知,A为强碱,B为弱碱 |
14.下列与生产、生活相关的化学知识描述正确的是( )
| A. | 使用高效低毒的农药,既能提高作物产量,又能降低农药残留量 | |
| B. | 食品包装袋中常放入生石灰作为抗氧化剂,防止食品变质 | |
| C. | 水瓶胆中的水垢可用饱和食盐水清洗 | |
| D. | 明矾可用于净水,也可用于淡化海水 |
11.下列有关仪器的使用方法或实验操作正确的是( )
| A. | 做金属钠与水反应实验时,剩余的钠不能再放入原试剂瓶 | |
| B. | 酸式滴定管装标准液前,必须先用该溶液润洗 | |
| C. | 锥形瓶用作反应容器时一定不能加热 | |
| D. | 用容量瓶配溶液时,若加水超过刻度线,立即用滴定管吸出多余液体 |
18.要使100mL 2mol/LNaOH溶液的物质的量浓度增大1倍,可采取的措施是( )
| A. | 加100mL水将溶液稀释 | |
| B. | 向溶液中加入0.2molNaOH固体,并使之完全溶解 | |
| C. | 将溶剂蒸发掉一半 | |
| D. | 将原溶液浓缩至50mL(无NaOH析出) |
8.下列与F-具有相同质子数和电子数的微粒是( )
| A. | NH4+ | B. | NH2- | C. | NH3 | D. | Na+ |
15.同温同压下,相同体积的氧气和氨气,可以肯定的是( )
| A. | 质量相等 | B. | 物质的量相等 | ||
| C. | 都含有6.02×1023个分子 | D. | 电子数相等 |
11.下列单质或化合物的性质描述正确的是( )
| A. | NaHC03水溶液显碱性,溶液中阳离子电荷总数小于阴离子电荷总数 | |
| B. | SiO2不跟碱反应,但可与氢氟酸反应 | |
| C. | NO2难液化,易溶于水并跟水反应 | |
| D. | Fe3O4能与浓盐酸反应生成FeCl2和FeCl3 |

 Fe(OH)3(胶体)+ KOH + 。
Fe(OH)3(胶体)+ KOH + 。