题目内容
5.(1)0.3mol的氧气和0.2mol的臭氧(O3),它们的质量之比为1:1,它们所含分子数之比为3:2,所含氧原子数之比为1:1.(2)在V L Al2(SO4)3溶液中,测得含Al3+的质量为a g,则Al2(SO4)3溶液的物质的量浓度为$\frac{a}{54V}$moL/L,SO42-的物质的量浓度为$\frac{a}{18V}$moL/L.
(3)ag氧气中含n个氧原子,则阿伏加德罗常数为$\frac{16n}{a}$;标况下VL氢气中含n个氢分子,则阿伏加德罗常数为$\frac{22.4n}{V}$;Ag氢气和氧气的混合气体中含m个H2和n个O2,则阿伏加德罗常数为$\frac{2m+32n}{A}$.
(4)在标况下,某气体的密度是1.96g/L,则它的摩尔质量是44g/mol,该气体在相同温度和压强下相对氢气的密度是22.
分析 (1)根据m=nM计算氧气与臭氧质量之比,根据N=nNA可知,分子数目之比等于其物质的量之比,氧气含有氧原子为氧气分子2倍,臭氧含有氧原子数目为臭氧3倍,据此计算含有氧原子数目之比,根据V=nVm可知,相同条件下气体体积之比等于其物质的量之比;
(2)根据n=$\frac{m}{M}$计算Al3+的物质的量,溶液中n[Al2(SO4)3]=$\frac{1}{2}$n(Al3+),再利用n(Al3+):n(SO42-)=2:3计算VL溶液中n(SO42-);
(3)根据n=$\frac{m}{M}$计算出ag氧气中含有氧原子的物质的量,根据n=$\frac{V}{{V}_{m}}$计算出标准状况下VL氢气的物质的量,然后根据NA=$\frac{N}{n}$计算出阿伏伽德罗常数;根据n=$\frac{N}{{N}_{A}}$表示出氢气和氧气的物质的量,再根据m=nM列式计算出NA即可;
(4)计算出标况下22.4L该气体的质量,就可以知道该气体的摩尔质量及相对分子质量.
解答 解:(1)根据m=nM可知,0.3mol的氧气和0.2mol的臭氧(O3)的质量之比为:0.3mol×32g/mol:0.2mol×48g/mol=1:1,根据N=nNA可知,二者含有分子数目之比为0.3mol:0.2mol=3:2,含有氧原子数目之比为3×2:2×3=1:1,故答案为:1:1;3:2;1:1;
(2)agAl3+的物质的量=$\frac{ag}{27g/mol}$=$\frac{a}{27}$mol,
溶液中n[Al2(SO4)3]=$\frac{1}{2}$n(Al3+)=$\frac{1}{2}$×$\frac{a}{27}$mol=$\frac{a}{54}$mol,
故c[Al2(SO4)3]=$\frac{\frac{a}{54}}{V}$=$\frac{a}{54V}$mol/L,所以SO42-的物质的量浓度为$\frac{a}{54V}×3$=$\frac{a}{18V}$mol/L,故答案为:$\frac{a}{18V}$;
(3)ag O2分子的物质的量为$\frac{ag}{32g/mol}$=$\frac{a}{32}$mol,含有氧原子的物质的量为$\frac{a}{32}$mol×2=$\frac{a}{16}$mol,则阿伏加德罗常数为:NA=$\frac{N}{n}$=$\frac{\frac{n}{a}}{16}mol$=$\frac{16n}{a}$mol-1;
标况下VL氢气的物质的量为$\frac{VL}{22.4L/mol}$=$\frac{v}{22.4}$mol,$\frac{v}{22.4}$mol氢气分子中个H2分子,则阿伏加德罗常数为NA=$\frac{N}{n}$=$\frac{\frac{n}{V}}{22.4}$=$\frac{22.4n}{V}$mol-1;
设阿伏加德罗常数为NA,则氧气和氢气的质量为2g/mol×$\frac{m}{{N}_{A}}$mol+32g/mol×$\frac{n}{{N}_{A}}$mol=Ag,解得:NA=$\frac{2m+32n}{A}$mol-1,
故答案为:$\frac{16n}{a}$mol-1;$\frac{22.4n}{V}$mol-1;$\frac{2m+32n}{A}$mol-1;
(4)标况下,摩尔质量为1.96g/L×22.4L/mol≈44g/mol,该气体在相同温度和压强下相对氢气的密度是$\frac{44}{2}$=22,故答案为:44g/mol;22.
点评 本题考查了物质的量的有关计算,题目难度中等,明确物质的量与阿伏伽德罗常数、摩尔质量的关系为解答的关键,试题充分考查了学生的分析、理解能力及化学计算能力.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案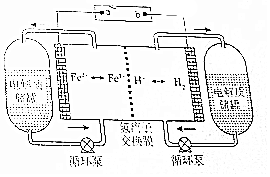 H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )
H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )| A. | 充电时,a连接直流电源的正极 | |
| B. | 充电时,阴极的电极反应式为2Fe3++2e-═2Fe2+ | |
| C. | 放电时,右侧电解质储罐中的SO42-浓度逐渐增加 | |
| D. | 放电时,当转移0.1mol e-时,透过交换膜的离子有0.2mol |
| A. | B和C一定都是固体 | B. | B和C一定都是气体 | ||
| C. | 若C为固体,则B一定是气体 | D. | B和C不可能都是气体 |
| A. | 当a≥b时,发生的离子反应为SO32-+Cl2+H2O=SO42-+2H++2Cl- | |
| B. | 当5a=4b时,发生的离子反应为4SO32-+2I-+5Cl2+4H2O=4SO42-+I2+8H++10Cl- | |
| C. | 当a≤b≤$\frac{3}{2}$a时,反应中转移电子的物质的量n(e-)为a mol≤n(e-)≤3a mol | |
| D. | 当a<b<$\frac{3}{2}$a时,溶液中SO42-、I-与Cl-的物质的量之比为a:(3a-2b):2b |
| A. | 用铂作电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| B. | 以铜做电极电解硫酸铜溶液:2Cu2++2H2O $\frac{\underline{\;电解\;}}{\;}$4H++2Cu+O2↑ | |
| C. | 甲烷/KOH燃料电池正极反应:O2+4H++4e-═2H2O | |
| D. | 高铁电池 3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH充电时的阳极反应:Fe(OH)3-3e-+5 OH-═FeO42-+4H2O |
| A. | 常温下,反应 C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| B. | 合成氨反应 N2(g)+3H2(g)?2NH3(g)△H<0,加入催化剂能加快化学反应速率并提高转化率 | |
| C. | 甲烷和乙醇的燃烧热分别是 891.0 kJ/mol、1366.8 kJ/mol,利用甲烷更“低碳” | |
| D. | 氢氧燃料电池发电,比氢气直接在空气中燃烧发电能量转化率高 |
| pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 300 | 230 | 169 | 58 |
| 30 | 158 | 108 | 50 | 15 |
| 50 | 31 | 26 | 15 | 7 |
(2)在30℃、pH=5.0条件下,O3的分解速率为2.00×10-4 mol•L-1•min-1,O2的浓度为0.015mol/L.
(3)据表中的递变规律,推测O3在下列条件下分解速率的关系:Ⅰ<(填“>”“<”或“=”)Ⅱ.
Ⅰ.40℃,pH=3.0
Ⅱ.30℃,pH=7.0.