题目内容
18.设 NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5 NA | |
| B. | 常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为 NA | |
| C. | 50 mL 18.4 mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46 NA | |
| D. | 密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6 NA |
分析 A、标况下HF为液态;
B、乙烯和丙烯的最简式均为CH2;
C、铜只能和浓硫酸反应,和稀硫酸不反应;
D、氮气和氢气的反应为可逆反应.
解答 解:A、标况下HF为液态,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、乙烯和丙烯的最简式均为CH2,故7.0g混合物中含有的CH2的物质的量为0.5mol,则含有氢原子为NA个,故B正确;
C、铜只能和浓硫酸反应,和稀硫酸不反应,故浓硫酸不能反应完全,故生成二氧化硫分子个数小于0.46NA个,故C错误;
D、氮气和氢气的反应为可逆反应,不能进行完全,故转移的电子数小于0.6NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目
13.常温下,将a mol/L 的MOH(可溶性弱碱)与b mol/L盐酸等体积混合,已知相同条件下MOH的电离程度大于M+的水解程度,则下列有关推论不正确的是( )
| A. | 若混合后溶液pH=7,则c(M+)=c(Cl-) | |
| B. | 若b=2a,则c(Cl-)>c(M+)>c(H+)>c(OH-) | |
| C. | 若a=2b,则c(M+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 若混合后溶液满足c(H+)=c(OH-)+c(MOH),则可推出a=b |
6.化学与生活息息相关,下列说法不正确的是( )
| A. | 乙烯可作为水果的催熟剂 | |
| B. | 用食醋可除去热水壶内壁的水垢 | |
| C. | 烹鱼时加适量醋和酒可以增加香味 | |
| D. | 医用酒精消毒是利用其氧化性使蛋白质变性 |
13.某烃的折线式为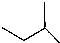 ,下列有关叙述正确的是( )
,下列有关叙述正确的是( )
 ,下列有关叙述正确的是( )
,下列有关叙述正确的是( )| A. | 该烃的分子式是C5H10 | B. | 与C4H10互为同系物 | ||
| C. | 分子中只有极性共价键 | D. | 能与溴水反应使其褪色 |
3.下列有关试验的做法不正确的是( )
| A. | 用加热分解的方法区分碳酸钠和碳酸氢钠两种固体 | |
| B. | 配置0.1000mol•L-1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 | |
| C. | 检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 | |
| D. | 分液时,分液漏斗的顶塞应打开或使塞上凹槽与壁上小孔对准 |
10.下列叙述正确的是( )
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 物质的摩尔质量等于该物质的相对分子质量 | |
| C. | O22-离子的摩尔质量是32 g•mol-1 | |
| D. | 1 mol H2O的质量为18 g•mol- |
8.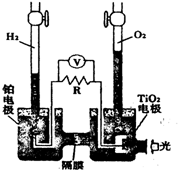 在光照射下可使水分解:2H2O $?_{光}^{TiO_{2}}$ 2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
在光照射下可使水分解:2H2O $?_{光}^{TiO_{2}}$ 2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
 在光照射下可使水分解:2H2O $?_{光}^{TiO_{2}}$ 2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
在光照射下可使水分解:2H2O $?_{光}^{TiO_{2}}$ 2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )| A. | 该装置可以将电能转化为化学能 | |
| B. | 铂电极上发生的反应为:2H++2e-=H2↑ | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置工作时,TiO2电极附近溶液的pH变大 |
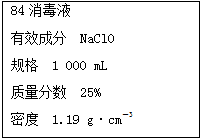 已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题: