题目内容
12.硫酸工业中以-定比例的(NH4)SO3、NH4HSO3混合溶液吸收尾气中的SO2.试回答下列问题(气体的体积均已换算为标准状况).(1)写出吸收过程中反应的化学方程式(NH4)2SO3+H2O+SO2=2NH4HSO3.
(2)写出NH4HSO3溶液与足量NaOH溶液在加热的条件下发生反应的离子方程式:HSO3-+NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+SO32-
(3)分析吸收液的组成:①取0.1L吸收液,向其中加入足量NaOH溶液,充分加热,产生1.12L气体;②另取0.1L吸收液,向其中加入足量的H2SO4溶液,充分加热,产生0.896L气体.则原吸收液中(NH4)2SO3与NH4HSO3的物质的量之比为1:3.
分析 (1)根据亚硫酸铵和水和二氧化硫反应生成亚硫酸氢铵进行解答;
(2)NH4HSO3溶液与足量NaOH溶液在加热的条件下发生反应生成亚硫酸钠、氨气和水;
(3)取0.1L吸收液,向其中加入足量NaOH溶液,充分加热,铵根离子和碱反应生成氨气,另取0.1L吸收液,再向其中加入足量的H2SO4溶液,充分加热,产生0.896L气体为二氧化硫,根据氮、硫守恒解答.
解答 解:(1)硫酸工业以一定比例的(NH4)2SO3、NH4HSO3混合溶液吸收尾气中的SO2,亚硫酸氢铵与二氧化硫不反应,亚硫酸铵和水和二氧化硫反应:(NH4)2SO3+H2O+SO2=2NH4HSO3,
故答案为:(NH4)2SO3+H2O+SO2=2NH4HSO3;
(2)NH4HSO3溶液与足量NaOH溶液在加热的条件下发生反应的离子方程式为:HSO3-+NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+SO32-,
故答案为:HSO3-+NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+SO32-;
(3)假设气体均为标况,1.12L气体为0.05mol,产生0.896L气体为0.04mol,设原混合液中(NH4)2SO3与NH4HSO3的物质的量分别为X、Y,取0.1L吸收液,向其中加入足量NaOH溶液,充分加热,发生反应:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,则2X+Y=0.05mol(根据氮守恒)①,另取0.1L吸收液,再向其中加入足量的H2SO4溶液,充分加热,发生反应:HSO3-+H+═SO2↑+H2O,则X+Y=0.04mol(根据硫守恒)②,联①②可得:X=0.01mol,Y=0.03mol,则原混合液中(NH4)2SO3与NH4HSO3的物质的量之比为1:3,
故答案为:1:3.
点评 本题考查了混合物反应的计算、化学方程式、离子方程式的书写,题目难度中等,明确发生反应的原理为解答关键,注意掌写离子方程式、化学方程式的书写原则,试题培养了学生的分析能力及化学计算能力.

 能考试全能100分系列答案
能考试全能100分系列答案| A. | 1 L 0.1 mol/L MgCl2溶液中含Cl-数为0.1NA | |
| B. | 1mol Na完全转化为Na2O2时,失去的电子数目为2NA | |
| C. | 含有NA个氢原子的氢气的体积约为11.2L | |
| D. | 1.8g NH4+中所含电子数为NA |
| A. | 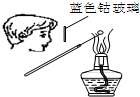 检验Na2CO3中的Na+ | B. | 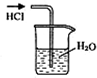 吸收HCl | ||
| C. | 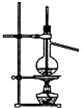 石油的蒸馏 | D. | 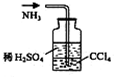 吸收NH3 |
| A. | 道尔顿发现原子--“空心球”模型 | |
| B. | 汤姆逊发现电子--“葡萄干布丁”模型 | |
| C. | 卢瑟福进行α粒子散射实验--“核式”模型 | |
| D. | 玻尔解释氢原子光谱--“电子分层排布”模型 |
 常温下,将氯气缓慢通入水中至饱和,再向其中缓慢滴加0.1 mol•L-1 NaOH溶液,整个过程中pH变化如图所示,下列有关叙述不正确的是( )
常温下,将氯气缓慢通入水中至饱和,再向其中缓慢滴加0.1 mol•L-1 NaOH溶液,整个过程中pH变化如图所示,下列有关叙述不正确的是( )| A. | a点时,某同学用玻璃棒蘸取溶液滴在蓝色的石蕊试纸上,试纸最终变红 | |
| B. | a-b段,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$增大 | |
| C. | b点对应溶液中:c(Cl-)>c(H+)>c(HClO)>c(ClO-)>c(OH-) | |
| D. | c点对应溶液中:c(Na+)=2c(ClO-)+c(HClO) |
| A. | ①减小,②不变,③减小 | B. | ①增大,②不变,③减小 | ||
| C. | ①增大,②不变,③增大 | D. | ①减小,②不变,③增大 |

| A. | 13种 | B. | 12种 | C. | 11种 | D. | 10种 |
| A. | 1mol苯酚与3mol H2发生加成反应 | B. | 苯酚能和NaOH溶液反应 | ||
| C. | 苯酚燃烧产生带浓烟的火焰 | D. | 苯酚与浓溴水反应生成三溴苯酚 |