题目内容
4.某实验小组设计了如图装置对焦炭还原二氧化硅的气体产物的成分进行探究.
已知:PdCl2溶液可用于检验CO,反应的化学方程式为CO+PdCl2+H2O═CO2+2HCl+Pd↓(产生黑色金属钯粉末,使溶液变浑浊).
(1)实验的主要步骤如下:
①点燃酒精喷灯
②检查装置的气密性
③通入N2一段时间
④向A的硬质玻璃管中装入焦炭(过量)与二氧化硅混合物共m g则正确的操作顺序是②④③①.
(2)实验时要通入足够长时间的N2,其原因是要用氮气将装置中的空气排尽,避免空气中的氧气、二氧化碳、水蒸气对实验产生干扰.
(3)装置D中所盛试剂为C(填序号)
A.NaOH溶液 B.Ca(OH)2溶液 C.PdCl2溶液 D.稀H2SO4溶液
(4)若装置C、D中溶液均变浑浊,且经检测两气体产物的物质的量相等,则A中反应的化学方程式为3SiO2+4C $\frac{\underline{\;高温\;}}{\;}$2CO2+2CO+3Si.实验结束后,C装置增重ng,求m g混合物中SiO2的质量分数$\frac{45n}{22}$×100%.
分析 某实验小组设计了如图装置对焦炭还原二氧化硅的气体产物的成分进行探究,碳与二氧化硅反应要在高温下进行,而高温下碳与空气中氧气反应,所以实验时要将装置中的空气排尽,利用氮气排净装置内的空气,关闭活塞K,点燃酒精灯发生反应生成一氧化碳,装置B为安全瓶,根据元素守恒,碳与二氧化硅反应可能生成一氧化碳也可能生成二氧化碳,所以C装置用来检验有没有二氧化碳,D装置用来检验一氧化碳;通过装置D中PdCl2溶液检验一氧化碳生成的生成,
(1)实验步骤为②检查装置的气密性,④向A的硬质玻璃管中装入焦炭(过量)与二氧化硅混合物共m g,③通入N2一段时间,①点燃酒精喷灯;
(2)碳与二氧化硅反应要在高温下进行,而高温下碳与空气中氧气反应,所以实验时要将装置中的空气排尽,利用氮气排净装置内的空气;
(3)根据元素守恒,碳与二氧化硅反应可能生成一氧化碳也可能生成二氧化碳,所以C装置用来检验有没有二氧化碳,D装置用来检验一氧化碳;
(4)若装置C、D中溶液均变浑浊,说明既有二氧化碳又有一氧化碳,检测两气体产物的物质的量相等,根据元素守恒可写出化学方程式;实验结束后,C装置增重ng为吸收的二氧化碳质量,两气体产物的物质的量相等计算得到一氧化碳和二氧化碳物质的量,化学方程式计算得到二氧化硅质量,得到质量分数;
解答 解:(1)实验步骤为②检查装置的气密性,④向A的硬质玻璃管中装入焦炭(过量)与二氧化硅混合物共m g,③通入N2一段时间,①点燃酒精喷灯,正确的操作顺序为:②④③①,故答案为:②④③①;
(2)碳与二氧化硅反应要在高温下进行,而高温下碳与空气中氧气反应,所以实验时要将装置中的空气排尽,所以实验时要通人足够长时间的N2,
故答案为:要用氮气将装置中的空气排尽,避免空气中的氧气、二氧化碳、水蒸气对实验产生干扰;
(3)根据元素守恒,碳与二氧化硅反应可能生成一氧化碳也可能生成二氧化碳,所以C装置用来检验有没有二氧化碳,D装置用来检验一氧化碳,所以置C、D中所盛试剂分别为澄清石灰水、PdCl2溶液,
故答案为:C;
(4)若装置C、D中溶液均变浑浊,说明既有二氧化碳又有一氧化碳,检测两气体产物的物质的量相等,根据元素守恒可知化学方程式为3SiO2+4C$\frac{\underline{\;高温\;}}{\;}$2CO2+2CO+3Si,
实验结束后,C装置增重ng为吸收的二氧化碳质量,两气体产物的物质的量相等计算得到一氧化碳和二氧化碳物质的量,
n(CO2)=n(CO)=$\frac{ng}{44g/mol}$=$\frac{n}{44}$mol,
3SiO2+4C$\frac{\underline{\;高温\;}}{\;}$2CO2+2CO+3Si,
3 2
n $\frac{n}{44}$mol
n=$\frac{3n}{88}$mol,
二氧化硅质量分数=$\frac{\frac{3n}{88}mol×60g/mol}{mg}$×100%=$\frac{45n}{22}$×100%,
故答案为:3SiO2+4C$\frac{\underline{\;高温\;}}{\;}$2CO2+2CO+3Si;$\frac{45n}{22}$×100%
点评 本题考查了实验探究反应产物的实验过程分析判断,主要是装置作用和试剂选择、定量计算等,掌握基础是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA | |
| B. | 在标况下,22.4LHF和22.4LC2H4原子个数比为1:3 | |
| C. | 6.0gSiO2晶体中含有0.4NA个Si-O键 | |
| D. | 1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA |
| A. | 在相同条件下pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度前者比后者大 | |
| B. | 反应NH3(g)+HCl(g)?NH4Cl(s)能自发进行,则该反应△H>0 | |
| C. | 锌与稀硫酸反应时加入少量硫酸铜,反应加快的主要原因是Cu2+水解增大了c(H+) | |
| D. | 一定条件下,反应2SO2(g)+O2(g)?2SO3(g)△H<0达到平衡后,升高体系温度,反应重新达到平衡前,有2v正(O2)<v逆(SO3) |
 ≡C-CH3的分子结构,下列说法正确的是( )
≡C-CH3的分子结构,下列说法正确的是( )| A. | 除苯环外的其余碳原子有可能都在一条直线上 | |
| B. | 除苯环外的其余碳原子不可能都在一条直线上 | |
| C. | 12个碳原子不可能都在同一平面上 | |
| D. | 所有原子有可能都在同一平面上 |
| A. | 一个苯环上已经连有-CH3、-CH2CH3、-OH三种基团,如果在苯环上再连接一个-CH3,其同分异构体有16种 | |
| B. | HOCH2CH(CH3)2与(CH3)3COH属于碳链异构 | |
| C. | 除去乙醇中的少量水,方法是加入新制生石灰,经过滤后即得乙醇 | |
| D. | 除去乙酸乙酯中的乙酸和乙醇杂质,可加入足量烧碱溶液,通过分液即得乙酸乙酯 |
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| CO2体积(mL) | 50 | 120 | 232 | 290 | 310 |
(2)假设溶液体积不变,4~5min时间段以盐酸的浓度变化来表示的该反应速率为1/560vmol•L-1•min-1.
(3)为了降低上述化学反应的反应速率,向溶液中加入下列物质,你认为可行的是a、d(填编号).
a.蒸馏水 b.浓盐酸 c.NaCl固体 d.NaCl溶液
(4)除了上述方法外,你认为还可以采取哪些措施来降低化学反应速率?(试写两条)降低反应温度,
减少接触面积.
| A. | 14 g分子式为CnH2n的烃中含有的C-H键的数目为2NA | |
| B. | 2.24 L(标准状况)甲烷与7.1 g氯气在光照条件下反应得到CH3Cl的分子数为0.1NA | |
| C. | 含有10.7 g Fe(OH)3的氢氧化铁胶体中,氢氧化铁胶粒总数为0.1NA | |
| D. | 100g 17%的氨水,溶液中含有的NH3分子数为NA |
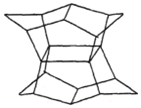 1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图的多环有机分子,因其形状像东方塔式庙宇,所以该分子也就称为pagodane(庙宇烷),有关该分子的说法不正确的是( )
1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图的多环有机分子,因其形状像东方塔式庙宇,所以该分子也就称为pagodane(庙宇烷),有关该分子的说法不正确的是( )| A. | 分子式为C20H20 | B. | 一氯代物的同分异构体只有两种 | ||
| C. | 分子中含有4个亚甲基(-CH2-) | D. | 分子中含有12个五元碳环 |