题目内容
16.已知室温时AgBr的溶解度是8.9×10-7mol/L,MgNH4PO4溶解度是6.3×10-8,求AgBr、MgNH4PO4的溶度积?分析 室温时AgBr的溶解度是8.9×10-7mol/L,则该温度下AgBr饱和溶液中:c(Ag+)=c(Br-)=8.9×10-7mol/L,根据Ksp(AgBr)=c(Ag+)•c(Br-)计算出溴化银的溶度积;
MgNH4PO4溶解度是6.3×10-8,则MgNH4PO4饱和溶液中:c(Mg2+)=c(NH4+)=c(PO43-)=6.3×10-8mol/L,根据Ksp(MgNH4PO4)=c(Mg2+)•c(NH4+)•c(PO43-)计算出其溶度积.
解答 解:室温时AgBr的溶解度是8.9×10-7mol/L,则该温度下AgBr饱和溶液中:c(Ag+)=c(Br-)=8.9×10-7mol/L,所以室温时溴化银的溶度积为:Ksp(AgBr)=c(Ag+)•c(Br-)=8.9×10-7×8.9×10-7=7.9×10-13;
MgNH4PO4溶解度是6.3×10-8,则MgNH4PO4饱和溶液中:c(Mg2+)=c(NH4+)=c(PO43-)=6.3×10-8mol/L,
所以室温时MgNH4PO4的溶度积为:Ksp(MgNH4PO4)=c(Mg2+)•c(NH4+)•c(PO43-)=(6.3×10-8)3=2.5×10-22,
答:室温时溴化银的溶度积为7.9×10-13;MgNH4PO4的溶度积为2.5×10-22.
点评 本题考查了难溶物溶度积的计算,题目难度中等,明确难溶物溶解平衡及其溶度积的表达式为解答关键,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
6.下列有关物质用途的叙述错误的是( )
| A. | 氯气可用于自来水消毒 | |
| B. | 40%的甲醛水溶液可用作防腐剂,浸制生物标本 | |
| C. | 工业酒精可用于酿造饮用酒 | |
| D. | 煤的气化和液化主要是生成清洁燃料,煤的干馏主要是生产化工原料 |
7.下列微粒电子式错误的是( )
| A. | 氯原子 | B. | 硫离子 | C. | 溴离子 | D. | 钙离子Ca2+ |
1.欲检验某无色溶液中是否含有SO42-,CO32-,Cl-,下列操作或说法正确的是( )
| A. | 直接往该溶液中滴加稀H2S04后产生大量气泡,证明原溶液含C032- | |
| B. | 取少量溶液加入Ba(NO3)2溶液后产生白色沉淀,证明原溶液中含SO42- | |
| C. | 取少量溶液加入HCl酸化后滴加AgN03溶液产生白色沉淀,证明原溶液中含Cl-. | |
| D. | 取少量溶液加入HCl酸化后滴加BaCL2溶液产生白色沉淀,证明原溶液中含SO42- |
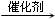
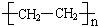 .
.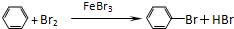 .
.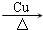 2CH3CHO+2H2O.
2CH3CHO+2H2O. .
.