题目内容
8.用双线桥出下列反应电子转移的方向和数目(1)2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KC1+3O2↑
(2)2H2S+SO2=3S↓+2H2O
(3)2Na+2H2O═2NaOH+H2↑
(4)2Na2O2+2H2O═4NaOH+O2↑
分析 (1)反应2KClO3═2KCl+3O2↑中Cl元素的化合价由+5价降低为-1价,O元素的化合价由-2价升高为0;
(2)二氧化硫中S元素的化合价由+4价降低为0,硫化氢中S元素的化合价由-2价升高为0;
(3)Na元素的化合价升高,H元素的化合价降低,转移的电子数为2e-;
(4)该反应中氯化氢失电子作还原剂,二氧化锰得电子作氧化剂,电子转移数目是2e-;
解答 解:(1)Cl元素的化合价由+5价降低为-1价,O元素的化合价由-2价升高为0,电子转移方向与数目为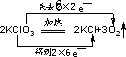 ,
,
故答案为: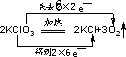 ;
;
(2)该反应中,硫化氢中硫元素的化合价变化由-2价变为0价,二氧化硫中硫元素的化合价变化为:由+4价变为0价,所以得失电子最小公倍数是4,则该反应中转移电子方向和数目为: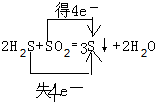 ,故答案为:
,故答案为: ;
;
(3)2Na+2H2O=2NaOH+H2↑中,H元素的化合价降低,H2O为氧化剂,H2为还原产物,“双线桥”表示电子转移方向及数目为 ,
,
故答案为: ;
;
(4)反应中Na2O2中部分O原子得电子化合价降低,部分O原子失电子化合价升高,2molNa2O2反应转移2mol电子,则标出电子转移数目与方向为: ,故答案为:
,故答案为: .
.
点评 本题考查氧化还原反应,注意电子、电荷守恒为解答的关键,注意双线桥表示电子转移方向与数目,明确发生的化学反应为解答的关键,题目难度不大.

练习册系列答案
相关题目
18.下列措施不能使产生氢气的速率加快的是( )
| A. | 用锌片替换铁片与稀硫酸反应 | B. | 将铁片与稀硫酸反应的温度升高 | ||
| C. | 用铁粉替换铁片与稀硫酸反应 | D. | 用浓硝酸替换稀硫酸与铁片反应 |
19.下列各组中的反应,属于同一反应类型的是( )
| A. | 由甲烷制四氯化碳,由乙烯与水反应制乙醇 | |
| B. | 由苯硝化制硝基苯,由乙醇遇到热的CuO固体得到单质铜 | |
| C. | 由苯和液溴制溴苯,由乙烯与溴水反应制1,2-二溴乙烷 | |
| D. | 由乙酸和乙醇制乙酸乙酯,由乙酸乙酯水解制乙酸和乙醇 |
13.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,22.4L乙醇在电池的负极放电生成CO2时,共失去12mol 电子 | |
| B. | 1mol/L碳酸钠溶液中,n(CO32-)+n(HCO3-)+n(H2CO3)=1mol | |
| C. | 25℃时,1L pH=1的醋酸溶液中含有H+的数目小于0.1NA | |
| D. | 电解精炼铜,当电路中转移NA个电子,阳极溶解的铜<32g,阴极析出铜32g |
20.一定温度下,mg下列物质在足量的氧气中充分燃烧后,产物与足量的过氧化钠充分反应,过氧化钠增加了mg,不符合此要求的物质是:( )
| A. | H2 | B. | CO | C. | H2和CO的混合物 | D. | CH4 |


