题目内容
14.金属元素铊的相关信息如图所示.下列有关卡片信息解读正确的是( )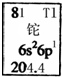
| A. | 铊元素的质量数是81 | B. | 铊原子的电子数为3 | ||
| C. | 铊原子的相对原子质量是204.4 | D. | 铊的金属性比铝的金属性强 |
分析 由“6s26p1”表示铊原子有6个电子层,最外层有3个电子.则Tl位于元素周期表中第六周期第ⅢA族,利用图示信息及第ⅢA族元素的性质的相似性和递变性来解答.
解答 解:A.铊元素的原子序数为81,故A错误;
B.铊原子的电子数等于原子序数,为81,故B错误;
C.204.4为元素的相对原子质量,为各种核素的平均值,故C错误;
D.同主族从上到下元素的金属性在增强,则铊的金属性比铝的金属性强,故D正确;
故选D.
点评 本题考查位置结构性质关系、元素周期表等,注意信息和所学知识的结合来解答,明确电子层数、最外层电子数与元素的位置的关系及元素周期律即可解答,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4. 美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛.有关该有机分子的说法正确的是( )
美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛.有关该有机分子的说法正确的是( )
 美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛.有关该有机分子的说法正确的是( )
美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛.有关该有机分子的说法正确的是( )| A. | 该有机物属于芳香烃 | B. | 该有机物属于苯的同系物 | ||
| C. | 该有机物分子中含有23个碳原子 | D. | 该有机物的一氯代物有3种 |
5.下列离子方程式与所述事实相符且正确的是( )
| A. | 用食醋和淀粉-KI试纸检验碘盐中的KIO3:IO3-+5I-+6H+═3I2+3H2O | |
| B. | 稀HNO3溶液与难溶于水的FeS固体:FeS+2H+═Fe2++H2S↑ | |
| C. | 碳酸氢钙与少量的NaOH溶液反应 Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | Na与水的反应Na+H2O═Na++OH-+H2↑ |
2. 向含Fe2+、Br-、I-各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中某种离子的物质的量的关系如图,下列说法中正确的是( )
向含Fe2+、Br-、I-各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中某种离子的物质的量的关系如图,下列说法中正确的是( )
 向含Fe2+、Br-、I-各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中某种离子的物质的量的关系如图,下列说法中正确的是( )
向含Fe2+、Br-、I-各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中某种离子的物质的量的关系如图,下列说法中正确的是( )| A. | Q是I- | |
| B. | Q是Br- | |
| C. | ab区间的反应:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | b点时溶液中只有Cl- |
9.下列有关实验原理、方法和结论都正确的是( )
| A. | 滴加盐酸酸化的BaCl2溶液,生成白色沉淀,原溶液中一定含有SO42- | |
| B. | 将钾盐溶于盐酸,产生能使澄清石灰水变浑浊的气体,该钾盐一定为K2C03 | |
| C. | 某固体进行焰色反应实验,火焰呈黄色,说明该固体为钠盐 | |
| D. | 向某溶液中滴加KSCN溶液,不变色,再滴加氯水显红色,则 溶液中一定含有Fe2+ |
6.现有以下两种有机物:① ②
② ,下列有关说法正确的是( )
,下列有关说法正确的是( )
 ②
② ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A. | 有机物①分子中所有原子不可能在同一平面上 | |
| B. | 有机物②与硝基乙烷(CH3CH2NO2)互为同分异构体 | |
| C. | 有机物①与②的核磁共振氢谱具有相同数目的吸收峰 | |
| D. | 有机物①能与浓溴水发生加成反应和取代反应 |
3.已知10.2g A与12.8g B完全反应,生成9.6g C和7.2g D及另一气体E,已知E的密度是H2密度的15.5倍.则气体E在标准状况下的体积( )
| A. | 2.24L | B. | 4.48L | C. | 5.6L | D. | 11.2L |
11.下列分离或提纯物质的方法正确的是( )
| A. | 用渗析的方法精制Fe(OH)3胶体 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 | |
| C. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| D. | 用加热→蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |