题目内容
19.碳酸钠和碳酸氢钠是生活中常见的物质.请回答下列问题.(1)碳酸钠俗称苏打或纯碱,等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者=后者(填>、<或=).
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为:HCO3-+H+=H2O+CO2↑.
(3)现有以下物质:①NaCl晶体 ②熔融的KNO3③氨水 ④铝 ⑤Cl2 ⑥酒精(C2H5OH)请回答下列问题(用序号):以上物质中能导电的是②③④;以上物质中属于强电解质的是①②.
(4)用“双线桥法”表示Cl2与NaOH反应电子转移的方向和数目:Cl2+2NaOH═Na Cl+Na ClO+H2O
(5)下列实验方案中,不能准确测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是C
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体直接用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
分析 (1)碳酸钠俗称苏打或纯碱,二者都可与盐酸反应生成二氧化碳气体,结合方程式判断;
(2)碳酸氢钠可与盐酸反应;
(3)电解质在熔融状态或水溶液中导电,金属可导电;常见强电解质有强酸、强碱和大多数盐;
(4)反应中Cl2+2NaOH═NaCl+NaClO+H2O中,只有Cl元素化合价发生变化,当有1mol Cl2反应时,转移1mol电子;
(5)实验方案是否可行,关键看根据测量数据能否计算出结果.
A.碳酸氢钠的不稳定性,加热分解,利用固体差量法即可计算出固体中碳酸氢钠的质量;
B.根据钠守恒,可列方程组求解;
C.应先把水蒸气排除才合理;
D.根据质量关系,可列方程组求解.
解答 解:(1)碳酸钠俗称苏打或纯碱,NaHCO3与HCl反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑;Na2CO3与HCl反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;由以上两个化学方程式可以看出,等物质的量的Na2CO3和NaHCO3分别与HCl反应,产生CO2的物质的量之比为1:1.
故答案为:苏打或纯碱;=;
(2)因NaHCO3与HCl反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑,则反应的离子方程式为HCO3-+H+=H2O+CO2↑,
故答案为:HCO3-+H+=H2O+CO2↑.
(3)②熔融的KNO3③氨水中含有自由移动的离子,能导电,④铝为金属晶体,能导电,:①NaCl晶体、②熔融的KNO3为强电解质,
故答案为:②③④;①②;
(4)反应Cl2+2NaOH═NaCl+NaClO+H2O中,只有Cl元素化合价发生变化,当有1mol Cl2反应时,转移1mol电子,所以其转移电子数是1,电子转移方向和数目为 ,
,
故答案为: ;
;
(5)A.NaHCO3受热易分解生成碳酸钠、水和二氧化碳,所以通过加热分解利用差量法即可计算出Na2CO3质量分数,故A正确;
B.Na2CO3和NaHCO3均可与盐酸反应生成水、二氧化碳和氯化钠,所以bg固体是氯化钠,利用守恒法可计算出Na2CO3质量分数,故B正确;
C.混合物与足量稀硫酸充分反应,也会生成水和二氧化碳,所以逸出的气体是二氧化碳,但会混有水蒸气,即碱石灰增加的质量不是二氧化碳的质量,不能测定含量,故C错误;
D.Na2CO3和NaHCO3都与Ba(OH)2反应,反应的方程式为CO32-+Ba2+=BaCO3↓、HCO3-+OH-+Ba2+=H2O+BaCO3↓,因此最后得到的固体是BaCO3,所以可以计算出Na2CO3质量分数,故D正确;
故选C.
点评 本题综合考查了Na2CO3和NaHCO3的性质,侧重于学生的分析能力和元素化合物知识的综合运用的考查,题目难度中等.

 能考试全能100分系列答案
能考试全能100分系列答案| A. | 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 | |
| B. | W与X形成的化合物中只含离子键 | |
| C. | W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 | |
| D. | X、Y、Z、W的原子半径依次减小 |
| A. | 熔点:青铜>铜 | B. | 热稳定性:NaHCO3>Na2CO3 | ||
| C. | 酸性:H2SiO3>H2CO3 | D. | 氧化性:Cl2>12 |
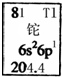
| A. | 铊元素的质量数是81 | B. | 铊原子的电子数为3 | ||
| C. | 铊原子的相对原子质量是204.4 | D. | 铊的金属性比铝的金属性强 |
| A. | 能全部透过滤纸 | B. | 没有丁达尔效应 | ||
| C. | 所得液体可能呈胶状 | D. | 所得物质一定是浊液 |
| A. | KNO3 K2SO4 K2CO3 K3PO4 | B. | NaOH KOH Ba(OH)2 Ca(OH)2 | ||
| C. | Na2O K2O CaO CO2 | D. | HNO3 H2SO4 H3PO4 HClO3 |
| A. | NO2-酸性氧化物 Na2O2-碱性氧化物 Al2O3-两性氧化物 | |
| B. | 漂白粉-混合物 胆矾-纯净物 HD-单质 | |
| C. | 纯碱-碱 硫化氢-酸 小苏打-酸式盐 | |
| D. | 盐酸-强电解质 硫酸钡-强电解质 醋酸-弱电解质 |
