题目内容
9.下列有关实验原理、方法和结论都正确的是( )| A. | 滴加盐酸酸化的BaCl2溶液,生成白色沉淀,原溶液中一定含有SO42- | |
| B. | 将钾盐溶于盐酸,产生能使澄清石灰水变浑浊的气体,该钾盐一定为K2C03 | |
| C. | 某固体进行焰色反应实验,火焰呈黄色,说明该固体为钠盐 | |
| D. | 向某溶液中滴加KSCN溶液,不变色,再滴加氯水显红色,则 溶液中一定含有Fe2+ |
分析 A.银离子和氯离子产生白色沉淀氯化银;
B.能使澄清石灰水变浑浊的气体是CO2和SO2,和酸反应生成CO2和SO2的离子有CO32-、SO32-、HCO3-或HSO3-;
C.含Na元素的固体,其焰色反应中火焰均呈黄色;
D.铁离子与硫氰化钾溶液显红色,氯气具有强氧化性,可将Fe2+氧化生成Fe3+.
解答 解:A.银离子和氯离子产生氯化银白色沉淀,所以该溶液中不一定含有SO42-,故A错误;
B.能使澄清石灰水变浑浊的气体是CO2和SO2,和酸反应生成CO2和SO2的离子有CO32-、SO32-、HCO3-和HSO3-,故B错误;
C.含Na元素的固体,其焰色反应中火焰均呈黄色,则该物质可能为钠盐或NaOH、氧化物等,故C错误;
D.向某溶液中滴加KSCN溶液,溶液不变色,说明原溶液中不含有铁离子,滴加氯水后溶液显红色,氯气具有强氧化性,可将Fe2+氧化生成Fe3+,故该溶液中一定含Fe2+,故D正确.
故选D.
点评 本题考查化学实验方案的评价,侧重实验操作和实验细节的考查,涉及离子的检验、焰色反应等,注重基础知识的考查,题目难度中等.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
19.下列物质中,既有离子键又有共价键的是( )
| A. | MgCl2 | B. | Ca(OH)2 | C. | H2O | D. | C60 |
17.下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A. | H + NO3- Fe 2+ Na + | B. | Ag + NO3- Cl - K + | ||
| C. | K + Ba 2+ OH - SO42- | D. | Cu 2+ NH4+ Br - OH - |
4.下列关于物质的分类说法正确的是 ( )
| A. | 纯碱、烧碱都属于碱 | |
| B. | 漂白粉、小苏打都属于纯净物 | |
| C. | 氯化铵、次氯酸都属于电解质 | |
| D. | 合成纤维和光导纤维都是新型无机非金属材料 |
14.金属元素铊的相关信息如图所示.下列有关卡片信息解读正确的是( )
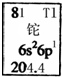

| A. | 铊元素的质量数是81 | B. | 铊原子的电子数为3 | ||
| C. | 铊原子的相对原子质量是204.4 | D. | 铊的金属性比铝的金属性强 |
1.2010年8月7日,甘肃甘南藏族自治州舟曲县发生特大泥石流,造成大量人员伤亡,其中饮用水安全在灾后重建中占有极为重要的地位,某研究小组提取三处被污染的水源进行了如下分析:并给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E五种常见化合物都是由下表中的离子形成的:
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液.
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解.
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃).
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验现象填写下列空白:
(1)写出化学式:ANaHCO3、BKNO3、CKAl(SO4)2、DCuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3.
(3)写出实验②发生反应的离子方程式Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.
(4)C常用作净水剂,用离子方程式表示其净水原理Al3++3H2O═Al(OH)3(胶体)+3H+.
| 阳离子 | K+、Na+、Cu2+、Al3+ |
| 阴离子 | SO42-、HCO3-、NO3-、OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液.
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解.
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃).
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验现象填写下列空白:
(1)写出化学式:ANaHCO3、BKNO3、CKAl(SO4)2、DCuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3.
(3)写出实验②发生反应的离子方程式Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.
(4)C常用作净水剂,用离子方程式表示其净水原理Al3++3H2O═Al(OH)3(胶体)+3H+.
18.物质分类对研究物质性质有指导意义,下列相关说法错误的是( )
| A. | 金属单质可能与非金属、酸、盐溶液发生反应 | |
| B. | 酸性氧化物能与碱反应且大部分能与水化合成酸 | |
| C. | 碱性氧化物能与酸反应且都能与水化合成碱 | |
| D. | 酸能与金属、碱性氧化物、碱、某些盐溶液发生反应 |
6.CO2(g)+H2(g)?CO(g)+H2O(g)
其化学平衡常数K和温度T的关系如表:
某温度下,在体积为10L的容器中将1.0mol CO与1.0mol H2O混合加热,一段时间后达到平衡状态,测得CO的物质的量为0.5mol.回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$.该反应的正反应方向△H>0(填“<”或“>”).
(2)上述数据对应的化学平衡状态建立的温度是830.
(3)若其它条件不变,1000℃时,测得容器中c(CO)=0.060mol•L-1,在这种情况下,该反应是否处于化学平衡状态否(选填是或否),此时,化学反应速率是v正小于v逆(选填大于、小于或等于),其原因是$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$=2.25>1.7,说明此时c(CO)大于平衡状态的浓度,所以v(逆)>v(正).
其化学平衡常数K和温度T的关系如表:
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$.该反应的正反应方向△H>0(填“<”或“>”).
(2)上述数据对应的化学平衡状态建立的温度是830.
(3)若其它条件不变,1000℃时,测得容器中c(CO)=0.060mol•L-1,在这种情况下,该反应是否处于化学平衡状态否(选填是或否),此时,化学反应速率是v正小于v逆(选填大于、小于或等于),其原因是$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$=2.25>1.7,说明此时c(CO)大于平衡状态的浓度,所以v(逆)>v(正).
 ):
):

 ,化合物V转化为化合物VI的反应类型为加成反应.
,化合物V转化为化合物VI的反应类型为加成反应. .
. 或
或 .
. )与化合物(
)与化合物( )能发生偶联反应生成一种抗抑郁药物,写出该抗抑郁药物的结构简式
)能发生偶联反应生成一种抗抑郁药物,写出该抗抑郁药物的结构简式 .
.
 .
. (要求:①能与FeCl3溶液发生显色反应;②苯环上一氯取代产物有2种)
(要求:①能与FeCl3溶液发生显色反应;②苯环上一氯取代产物有2种)