题目内容
19.下列对丙酸和甲酸乙酯的说法中不正确的是( )| A. | 它们互为同分异构体 | B. | 丙酸分子之间存在氢键 | ||
| C. | 它们可用核磁共振氢谱法鉴别 | D. | 它们可用KMnO4(H+)溶液鉴别 |
分析 丙酸中含-COOH,甲酸乙酯中含-CHO、-COO-,二者具有相同的分子式,结构不同,结合性质的差异及实验操作来解答.
解答 解:A.丙酸和甲酸乙酯的分子式都为C3H6O2,结构不同,属于同分异构体,故A正确;
B.丙酸含有-O-H键,可分子间含有氢键,沸点较高,故B正确;
C.丙酸中含-COOH,甲酸乙酯中含-CHO、-COO-,官能团不同,共价键种类不同,可用红外光谱法鉴别,丙酸和甲酸甲酯分子中的氢原子都有三种且三种氢原子峰面积之比都是3:2:1,不可用核磁共振氢谱法鉴别,故C错误;
D.甲酸乙酯中含-CHO,可被氧化,则可用KMnO4(H+)溶液鉴别,故D正确.
故选C.
点评 本题考查有机物的鉴别,为高频考点,把握物质性质的差异及实验操作的可行性为解答的关键,侧重羧酸、醛性质及溶解性考查,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
12.下列关于反应能量的说法正确的是( )
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,反应物总能量<生成物总能量 | |
| B. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,H2的燃烧热为241.8 kJ•mol-1 | |
| C. | 相同条件下,1 mol氢原子所具有的能量为E1,1 mol 氢分子的能量为E2,则2E1>E2 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,含1 mol NaOH的NaOH溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ 的热量 |
4.一种新型锂-氧电池,其能量密度极高.电池中添加碘化锂(LiI)和微量水,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$2
I2+4LiOH,对于该电池的说法不正确的是( )
I2+4LiOH,对于该电池的说法不正确的是( )
| A. | 放电时负极上I-被氧化 | |
| B. | 充电时Li+从阳极区移向阴极区 | |
| C. | 充电时阴极反应为:LiOH+e-═Li+OH- | |
| D. | 放电时正极反应为:O2+2H2O+4Li++4e-═4LiOH |
8.戊烷的同分异构体有几种(不考虑立体异构)( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
8.规范实验操作是获得实验成功的重要保证.下列化学实验操作正确的是( )
| A. | 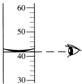 读出液体的体积 | B. | 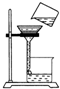 过滤 | C. |  熄灭酒精灯 | D. | 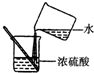 稀释浓硫酸 |
 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示. 甲学生用如1图所示装置证明溴和苯的反应是取代反应而不是加成反应.主要实验步骤如下:
甲学生用如1图所示装置证明溴和苯的反应是取代反应而不是加成反应.主要实验步骤如下: 中最多13个原子共平面.
中最多13个原子共平面.