题目内容
11.现将金属镁和铝的混合物9.9g完全溶解于500mL稀硝酸中,金属完全溶解(硝酸的还原产物只有NO).向所得溶液中加入烧碱溶液至金属离子恰好完全沉淀,得到沉淀25.2g,则硝酸的浓度可能为( )| A. | 1.2mol/L | B. | 2.0mol/L | C. | 2.4mol/L | D. | 3.0mol/L |
分析 金属与稀硝酸反应,即4HNO3+3e-→NO↑+2H2O+3NO3-,所以氧化性的硝酸是参加反应硝酸的$\frac{1}{4}$,而现将金属镁和铝的混合物9.9g,得到沉淀25.2g,含有氢氧根的质量为15.3g,氢氧根的物质的量为$\frac{15.3g}{17g/mol}$=0.9mol,根据电子转移守恒,则镁和铝转移电子的总物质的量为0.9mol,则参加反应的硝酸的物质的量为:$\frac{0.9}{3}×4$=1.2mol,根据c=$\frac{n}{V}$计算求解.
解答 解:金属与稀硝酸反应,即4HNO3+3e-→NO↑+2H2O+3NO3-,所以氧化性的硝酸是参加反应硝酸的$\frac{1}{4}$,而现将金属镁和铝的混合物9.9g,得到沉淀25.2g,含有氢氧根的质量为15.3g,氢氧根的物质的量为$\frac{15.3g}{17g/mol}$=0.9mol,根据电子转移守恒,则镁和铝转移电子的总物质的量为0.9mol,则参加反应的硝酸的物质的量为:$\frac{0.9}{3}×4$=1.2mol,c=$\frac{n}{V}$=$\frac{1.2mol}{0.5L}$=2.4mol/L,故选C.
点评 本题主要考查混合物有关计算,题目难度中等,侧重于学生运用电子转移守恒、质量守恒等解决复杂问题的能力,是一道考查能力的好题.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
1.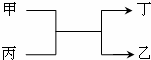 甲、乙为短周期同一主族元素的单质,丙、丁为氧化物,它们存在如图转化关系,下列各组的甲和乙一定符合的是( )
甲、乙为短周期同一主族元素的单质,丙、丁为氧化物,它们存在如图转化关系,下列各组的甲和乙一定符合的是( )
 甲、乙为短周期同一主族元素的单质,丙、丁为氧化物,它们存在如图转化关系,下列各组的甲和乙一定符合的是( )
甲、乙为短周期同一主族元素的单质,丙、丁为氧化物,它们存在如图转化关系,下列各组的甲和乙一定符合的是( )| A. | 钠和氢 | B. | 氧和硫 | C. | 碳和硅 | D. | 氟和氯 |
6.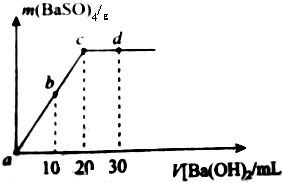 室温下,向20m1,物质的量浓度为0.35mol/L的H2SO4溶液中逐滴加人浓度的Ba(OH)2溶液,生成的沉淀与加人Ba(OH)2的体积如图(混合后体积变化忽略不计)下列说法不正确的是( )
室温下,向20m1,物质的量浓度为0.35mol/L的H2SO4溶液中逐滴加人浓度的Ba(OH)2溶液,生成的沉淀与加人Ba(OH)2的体积如图(混合后体积变化忽略不计)下列说法不正确的是( )
 室温下,向20m1,物质的量浓度为0.35mol/L的H2SO4溶液中逐滴加人浓度的Ba(OH)2溶液,生成的沉淀与加人Ba(OH)2的体积如图(混合后体积变化忽略不计)下列说法不正确的是( )
室温下,向20m1,物质的量浓度为0.35mol/L的H2SO4溶液中逐滴加人浓度的Ba(OH)2溶液,生成的沉淀与加人Ba(OH)2的体积如图(混合后体积变化忽略不计)下列说法不正确的是( )| A. | Ba(OH)2的物质的量浓密度为0.35mol/L | |
| B. | b时刻溶液中SO${\;}_{4}^{2-}$的浓度约为0.175mol/L | |
| C. | c时刻溶液显中性 | |
| D. | 实验过程中a、b、c三处溶液的导电能力c<b<a |
16.磷酸盐缓冲溶液对维持生物体内的正常pH和正常生理环境起重要作用.将0.2mol•L-1的NaH2PO4与0.2mol•L-1的Na2HPO4溶液以不同比例混合,可形成不同pH的缓冲溶液.
试回答下列问题:
(1)在pH=5.9的磷酸盐缓冲溶液中,c(Na+)=0.22mol/L(溶液混合时的体积变化忽略不计).
(2)欲直接利用NaH2PO4•2H2O和Na2HPO4•2H2O配制100mLpH=5.8的NaH2PO4-Na2HPO4缓冲溶液,需称量NaH2PO4•2H2O、Na2HPO4•2H2O的质量分别为2.87g、0.285g.
| pH | NaH2PO4溶液体积/mL | Na2HPO4溶液体积/mL |
| 5.7 | 93.5 | 6.5 |
| 5.8 | 92 | 8 |
| 5.9 | 90 | 10 |
| 6.0 | 87.7 | 12.3 |
(1)在pH=5.9的磷酸盐缓冲溶液中,c(Na+)=0.22mol/L(溶液混合时的体积变化忽略不计).
(2)欲直接利用NaH2PO4•2H2O和Na2HPO4•2H2O配制100mLpH=5.8的NaH2PO4-Na2HPO4缓冲溶液,需称量NaH2PO4•2H2O、Na2HPO4•2H2O的质量分别为2.87g、0.285g.
3.下列离子方程式表示正确的是( )
| A. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| B. | 铜与浓硫酸混合加热:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO42-+2H2O+SO2↑ | |
| C. | 过量的浓盐酸与铁屑反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 明矾溶液中滴加氢氧化钡溶液使沉淀质量最大:Al3++2SO42-+2Ba2++3OH-═2BaSO4↓+Al(OH)3↓ |
12.下列物质中,不属于天然高分子化合物的是( )
| A. | 蛋白质 | B. | 纤维素 | C. | 淀粉 | D. | 甘油 |
13.一种具有除草功效的有机物的结构简式如图所示.下列有关该化合物的说法正确的是( )


| A. | 能发生氧化、取代、加成反应 | |
| B. | 分子中含有2个手性碳原子 | |
| C. | 1 mol该化合物与足量浓溴水反应,最多消耗3 mol Br2 | |
| D. | 1 mol该化合物与足量NaOH溶液反应,最多消耗5 mol NaOH |

