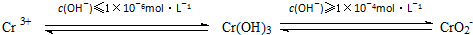题目内容
同温同压下,等质量的O2和SO2的分子个数比为 ,氧原子数比为 ,体积比为 ,密度比 .
考点:物质的量的相关计算
专题:计算题
分析:同温同压下,气体摩尔体积相等,根据N=
NA、n=
、V=
Vm、ρ=
进行计算.
| m |
| M |
| m |
| M |
| m |
| M |
| M |
| Vm |
解答:
解:同温同压下,气体摩尔体积相等,氧气的摩尔质量是32g/mol、二元化硫的摩尔质量是64g/mol,根据N=
NA知,等质量的O2和SO2的分子个数比等于其摩尔质量的反比=64g/mol:32g/mol=2:1,
根据n=
知,等质量的O2和SO2的物质的量之比等于摩尔质量的反比=64g/mol:32g/mol=2:1,每个分子中含有的O原子个数相等,所以二者的氧原子个数之比等于其分子数之比为2:1;
根据V=
Vm知,等质量的O2和SO2的体积之比等于摩尔质量的反比=64g/mol:32g/mol=2:1,
根据ρ=
知,其密度之比等于摩尔质量之比=32g/mol:64g/mol=1:2,
故答案为:2:1;2:1;2:1;1:2.
| m |
| M |
根据n=
| m |
| M |
根据V=
| m |
| M |
根据ρ=
| M |
| Vm |
故答案为:2:1;2:1;2:1;1:2.
点评:本题考查了物质的量的有关计算,明确物质的量的有关公式并灵活运用是解本题关键,题目难度不大.

练习册系列答案
相关题目
下列食品添加剂与类别对应正确的一组是( )
| A、着色剂_______苯甲酸钠 |
| B、调味剂_______食盐 |
| C、营养强化剂_______亚硝酸钠 |
| D、防腐剂_______苋菜红 |
下列各组中两种微粒所含电子数不相等的是( )
| A、H3O+和OH- |
| B、CO和N2 |
| C、HNO2和 NO2- |
| D、CH3+和NH4+ |
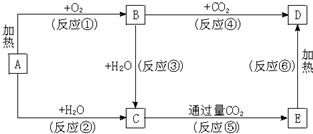
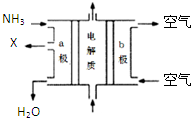 工业废水中含有多种有害成分,任意排放将造成严重污染,进行分类处理达标后才能排放.
工业废水中含有多种有害成分,任意排放将造成严重污染,进行分类处理达标后才能排放.