题目内容
 有A、B、C、D四种元素.已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大.B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区.C元素原子的外围电子层排布式为nsn-1npn-1. D原子M能层为全充满状态,且核外的未成对电子只有一个.请回答下列问题:
有A、B、C、D四种元素.已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大.B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区.C元素原子的外围电子层排布式为nsn-1npn-1. D原子M能层为全充满状态,且核外的未成对电子只有一个.请回答下列问题:(1)ACl3分子中A的杂化类型为
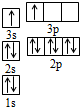
(2)某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了
(3)A、B、C三元素原子第一电离能由大到小的顺序为
(4)D的基态原子有
考点:晶胞的计算,原子核外电子排布,元素电离能、电负性的含义及应用,位置结构性质的相互关系应用,共价键的形成及共价键的主要类型,判断简单分子或离子的构型
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A、B、C、D四种元素.已知A原子的p轨道中有3个未成对电子,外围电子排布为ns2np3,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,应与水分子之间形成氢键,可推知A为N元素;B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,位于元素周期表的s区,原子核外电子排布式为1s22s22p63s2,则B为Mg元素;C元素原子的外围电子层排布式为nsn-1npn-1,s能级只能容纳2个电子,故n=3,则C为Si元素; D原子M能层为全充满状态,且核外的未成对电子只有一个,则原子核外电子数为2+8+18+1=29,故D为Cu,据此解答.
解答:
解:A、B、C、D四种元素.已知A原子的p轨道中有3个未成对电子,外围电子排布为ns2np3,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,应与水分子之间形成氢键,可推知A为N元素;B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,位于元素周期表的s区,原子核外电子排布式为1s22s22p63s2,则B为Mg元素;C元素原子的外围电子层排布式为nsn-1npn-1,s能级只能容纳2个电子,故n=3,则C为Si元素; D原子M能层为全充满状态,且核外的未成对电子只有一个,则原子核外电子数为2+8+18+1=29,故D为Cu,
(1)NCl3分子中N原子含有孤电子对=
=1,价层电子对数=3+1=4,则N原子采取sp3杂化,为三角锥形结构,
故答案为:sp3;三角锥形;
(2)3p能级能量高于3s能级,应填充满3s能级再填充3p能级,违背能量最低原理,
故答案为:能量最低原理;
(3)非金属性越强,第一电离能越大,故第一电离能N>Si>Mg,C60分子中每个原子只跟相邻的3个原子形成共价键,且每个原子最外层都满足8电子稳定结构,则每个C形成的这3个键中,必然有1个双键,这样每个C原子最外层才满足8电子稳定结构,双键数应该是C原子数的一半,而每个双键有1个π键,显然π键数目为30,
故答案为:N>Si>Mg;30;
(4)Cu的基态原子核外电子排布式为1s22s22p63s23p63d104s1,1s、2s、2p、3s、3p、3d、4s能级能量不同,有7种能量不同的电子;Cu2+的价电子排布式为3d9;
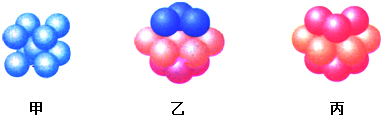
Cu为面心立方最密堆积,是ABC型方式堆积,故为图乙结构;晶胞中Cu原子数目=8×
+6×
=4,晶胞质量=4×
g,该晶体中一个晶胞的边长为a cm,则晶胞体积=(a cm)3=a3 cm3,则Cu晶体的密度=(4×
g)÷a3 cm3=
g/cm3,
若Cu的原子半径为r,则晶胞棱长=4r×
=2
r,则晶胞体积=(2
r)3,晶胞中Cu原子总体积=4×
πr3,则Cu晶胞这种堆积模型的空间利用率为
×100%,
故答案为:7;3d9;乙;
g/cm3;
×100%.
(1)NCl3分子中N原子含有孤电子对=
| 5-1×3 |
| 2 |
故答案为:sp3;三角锥形;
(2)3p能级能量高于3s能级,应填充满3s能级再填充3p能级,违背能量最低原理,
故答案为:能量最低原理;
(3)非金属性越强,第一电离能越大,故第一电离能N>Si>Mg,C60分子中每个原子只跟相邻的3个原子形成共价键,且每个原子最外层都满足8电子稳定结构,则每个C形成的这3个键中,必然有1个双键,这样每个C原子最外层才满足8电子稳定结构,双键数应该是C原子数的一半,而每个双键有1个π键,显然π键数目为30,
故答案为:N>Si>Mg;30;
(4)Cu的基态原子核外电子排布式为1s22s22p63s23p63d104s1,1s、2s、2p、3s、3p、3d、4s能级能量不同,有7种能量不同的电子;Cu2+的价电子排布式为3d9;
Cu为面心立方最密堆积,是ABC型方式堆积,故为图乙结构;晶胞中Cu原子数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 64 |
| NA |
| 64 |
| NA |
| 4×64 |
| a3?NA |
若Cu的原子半径为r,则晶胞棱长=4r×
| ||
| 2 |
| 2 |
| 2 |
| 4 |
| 3 |
4×
| ||
(2
|
故答案为:7;3d9;乙;
| 4×64 |
| a3?NA |
4×
| ||
(2
|
点评:本题是对物质结构的考查,题目综合性较大,涉及分子结构、杂化轨道、核外电子排布、电离能、晶胞计算等,是对学生综合能力的考查,(4)中晶胞空间利用率计算是难点、易错点,学习中注重相关基础的积累,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
-工业生产硫酸时,其中-步反应是2SO2+O2
2SO3,该反应正反应是放热反应.如果在密闭容器中进行反应,下列说法错误的是( )
| 400℃~520℃ |
| 催化剂 |
| A、升高温度可提高反应速率 |
| B、使用催化剂能增大反应速率 |
| C、增大氧气浓度可提高SO2的转化率 |
| D、达到化学平衡时SO2的浓度与SO3的浓度相等 |
对于易燃、易爆、有毒的化学物质,往往会在其包装上贴危险警告标签.下面所列物质中,贴错了标签的是
( )
| A | B | C | D | |
| 物质的 化学式 |
H2SO4(浓) | C2H5OH(酒精) | Hg(汞) | NaCl |
| 危险警 告标签 |
 |
 |
 |
 |
| A、A | B、B | C、C | D、D |
下列离子反应方程式正确的是( )
A、铜粉与98.3%的硫酸加热下反应:Cu+4H++SO42-
| ||||
B、电解饱和食盐水:2Cl-+2H+
| ||||
| C、向氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=[Al(OH)4]-+4NH4+ | ||||
| D、硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2=2Fe3++2H2O |