题目内容
5.氯气是一种重要的氧化剂.(1)实验室除了可用二氧化锰和浓盐酸反应抽取氯气,也可用氯酸钾和浓盐酸加热制备氯气,则反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑.若产生0.3molCl2,则消耗的还原剂的物质的量是0.6mol.
(2)将氯气通入足量的氯化亚铁溶液中,反应的离子方程式是2Fe2++Cl2=2Fe3++2Cl-,欲检验Fe2+是否全部被氧化在Fe3+的操作、现象及结论为取待测液,加入高锰酸钾,溶液褪色,证明有亚铁离子,亚铁离子没有全部被氧化,若是加入高锰酸钾,溶液不褪色,证明没有亚铁离子,亚铁离子全部被氧化.
(3)在加热条件下,浓NaOH溶液与氯气反应可获取NaClO3和氯化钠,则反应的离子方程式是3Cl2+6OH-=5Cl-+ClO3-+3H2O.
(4)已知在某温度下,将氯气通入烧碱液中,得到NaCl、NaClO和NaClO3的混合液.经测定,NaClO和NaClO3的物质的量之比为4:1,则反应中被氧化与被还原的氯元素的物质的量之比是9:5.
分析 (1)实验室用浓盐酸和二氧化锰制取氯气,根据反应物、生成物和反应条件写出反应方程式;根据氯气和转移电子之间的关系式、原子守恒计算还原剂的物质的量;
(2)通入氯气时Fe2+被氧化为铁离子;Fe3+能和SCN-生成络合物,溶液呈现血红色,亚铁离子不能,但是能使高锰酸钾退色;
(3)氯气和浓氢氧化钠溶液反应生成氯化钠、氯酸钠和水;
(4)Cl2生成ClO-与ClO3-是被氧化的过程,Cl2生成NaCl是被还原的过程,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,根据ClO-与ClO3-的物质的量浓度之比可计算失去电子的总物质的量,进而可计算得到电子的总物质的量,可计算被还原的氯元素的物质的量,则可计算被还原的氯元素和被氧化的氯元素的物质的量之比.
解答 解:(1)在加热条件下,浓盐酸和二氧化锰反应生成氯化锰、氯气和水,反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,该反应中作还原剂的浓盐酸反应后生成氯气,若产生1molCl2,根据原子守恒知,被还原的浓盐酸的物质的量是2mol,若产生0.3molCl2,则消耗的还原剂的物质的量是0.6mol,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;0.6mol;
(2)将氯气通入足量的氯化亚铁溶液中,反应的离子方程式是2Fe2++Cl2=2Fe3++2Cl-,检验Fe2+是否全部被氧化在Fe3+:向溶液中加入KSCN,出现血红色,证明溶液中亚铁离子被氧化为铁离子,取待测液,加入高锰酸钾,溶液褪色,证明有亚铁离子,亚铁离子没有全部被氧化,若是加入高锰酸钾,溶液不褪色,证明没有亚铁离子,亚铁离子全部被氧化,故答案为:2Fe2++Cl2=2Fe3++2Cl-;取待测液,加入高锰酸钾,溶液褪色,证明有亚铁离子,亚铁离子没有全部被氧化,若是加入高锰酸钾,溶液不褪色,证明没有亚铁离子,亚铁离子全部被氧化;
(3)氯气和浓氢氧化钠溶液反应生成氯化钠、氯酸钠和水,即3Cl2+6OH-=5Cl-+ClO3-+3H2O,故答案为:3Cl2+6OH-=5Cl-+ClO3-+3H2O;
(4)Cl2生成ClO-与ClO3-是被氧化的过程,化合价分别由0价升高为+1价和+5价,ClO-与ClO3-的物质的量浓度之比为4:1,则可设ClO-为4mol,ClO3-为1mol,被氧化的Cl共为5mol,失去电子的总物质的量为4mol×(1-0)+1mol×(5-0)=9mol,
氧化还原反应中氧化剂和还原剂之间得失电子数目相等,
Cl2生成NaCl是被还原的过程,化合价由0价降低为-1价,
则得到电子的物质的量也应为9mol,则被还原的Cl的物质的量为9mol,
所以被还原的氯元素和被氧化的氯元素的物质的量之比为9mol:5mol=9:5,
故答案为:9:5.
点评 本题考查氧化还原反应的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度不大,本题注意从氧化还原反应中氧化剂和还原剂之间得失电子数目相等的角度计算,注意守恒法的利用.

| A. | .乙醇和甲醇互为同系物 | B. | .乙醇不能用玉米生产 | ||
| C. | .乙醇的结构简式为C2H6O | D. | .乙醇只能发生取代反应 |
| 选项 | 实验事实 | 结论 |
| A | H2可在Cl2中燃烧 | 燃烧不一定有氧气参加 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 氧化铝熔点高于铝 |
| C | 将SO2通入含HClO的溶液中,生成H2SO4 | HClO酸性比H2SO4强 |
| D | 向FeCl2溶液中滴入KSCN溶液,在液面出现血红色 | Fe2+在空气中被氧化 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 1molCl2与足量Fe反应,转移的电子数为2NA | |
| B. | 标准状况下,22.4LSO3所含的分子数为NA个 | |
| C. | 足量铜与11.18mol/L浓硫酸反应可以得到SO2的分子数总数为9NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去电子数为2NA |
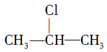 +NaOH$→_{△}^{醇}$CH3-CH═CH2+NaCl+H2O,
+NaOH$→_{△}^{醇}$CH3-CH═CH2+NaCl+H2O,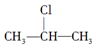 $→_{-NaCl,-H_{2}O}^{NaOH、醇、△}$CH3-CH═CH2下面是几种有机化合物的转化关系:
$→_{-NaCl,-H_{2}O}^{NaOH、醇、△}$CH3-CH═CH2下面是几种有机化合物的转化关系: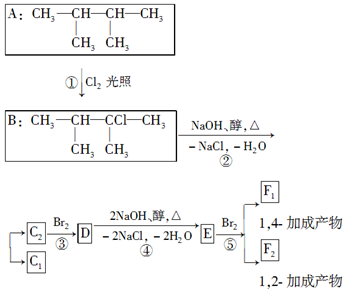
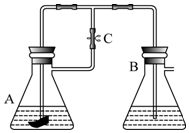 另外还有一种方法制备Fe(OH)2.在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.在锥形瓶B中加入的试剂是氢氧化钠溶液.这样生成的Fe(OH)2沉淀也能较长时间保持白色,理由是A中反应生成的氢气,充满了整个实验装置,外界空气不易进入.
另外还有一种方法制备Fe(OH)2.在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.在锥形瓶B中加入的试剂是氢氧化钠溶液.这样生成的Fe(OH)2沉淀也能较长时间保持白色,理由是A中反应生成的氢气,充满了整个实验装置,外界空气不易进入. 向恒容密闭容器中充入2.0mol A和3.0mol B,发生反应xA(g)+2B(g)?yC(g).恒温下反应10min后突然改变某一条件,12min时达到化学平衡状态I;18min时升高温度,22min时达到化学平衡状态II.容器中A、C的物质的量浓度随时间变化的曲线如图所示,请根据题给信息回答下列问题:
向恒容密闭容器中充入2.0mol A和3.0mol B,发生反应xA(g)+2B(g)?yC(g).恒温下反应10min后突然改变某一条件,12min时达到化学平衡状态I;18min时升高温度,22min时达到化学平衡状态II.容器中A、C的物质的量浓度随时间变化的曲线如图所示,请根据题给信息回答下列问题: