题目内容
17.常温下,在57.5g水中溶解2.5gCuSO4•5H2O恰好达到饱和,该溶液密度为1.2g/cm3求:①该溶液的体积
②该溶液中CuSO4的物质的量浓度
③取出20.0ml该溶液,配成浓度为0.10mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
分析 ①根据V=$\frac{m}{ρ}$计算溶液体积;
②根据c=$\frac{n}{V}$计算;
③根据稀释定律:稀释前后溶质的质量(物质的量)不会发生变化列式计算.
解答 解:①在57.5g水中溶解2.5gCuSO4•5H2O,则溶液的质量=17.5g+2.5g=20g,该溶液的体积V=$\frac{20g}{1.2g/c{m}^{3}}$=$\frac{50}{3}$cm3≈16.7cm3,答:该溶液的体积是16.7cm3;
②2.5gCuSO4•5H2O中硫酸铜物质的质量是2.5g×$\frac{160}{250}$×100%=1.6g,物质的量是$\frac{1.6g}{160g/mol}$=0.01mol,该溶液中CuSO4的物质的量浓度=$\frac{0.01mol}{\frac{50}{3}×1{0}^{-3}L}$=0.6mol/L,
答:溶液中CuSO4的物质的量浓度是0.6mol/L;
③取出20.0ml该溶液,配成浓度为0.10mol/L的稀溶液,设稀释后溶液的体积是VmL,则20.0mL×0.6mol/L=VmL×0.1mol/L,解得V=120mL,答:稀释后溶液的体积是120mL.
点评 本题考查物质的量浓度有关计算、物质的量有关计算,难度不大,注意对公式的理解与灵活应用.

练习册系列答案
相关题目
7.下列叙述中,正确的是( )
| A. | 用石墨电极电解加有酚酞的饱和食盐水,由于氢氧根离子向阳极移动,所以阳极区溶液首先变为红色 | |
| B. | 在铁管上镀锌时,铁管与直流电源的正极相接 | |
| C. | 给蓄电池充电时,直流电源的正极与蓄电池的正极相接,发生氧化反应 | |
| D. | 粗铜中含有少量锌、银等金属,电解精炼该粗铜时,阳极只发生的反应是:Cu-2e-═Cu2+ |
8.已知在常温下测得浓度均为0.1mol•L-1的四种溶液的pH如表:
(1)根据盐溶液的pH,可知①Ka(HClO)②Ka2(H2CO3)③Ka2(H2CO3)④Ka(HF)由大到小的顺序为④②①③(填序号)
(2)将CO2通入0.1mol•L-1的Na2CO3溶液中,至溶液呈中性,则溶液中2c(CO32-)+c(HCO3-)=0.2mol•L-1(忽略溶液体积变化)
(3)常温下,向0.1mol•L-1的HF溶液加水稀释的过程中,下列表达式的值变大的是C
A.c(H+) B.c(H+•c(OH-) C.$\frac{c(O{H}^{-})}{c({H}^{+})}$ D.$\frac{c({H}^{+})•c({F}^{-})}{c(HF)}$
(4)向84消毒液中通入少量的CO2,发生反应的化学方程式为NaClO+CO2+H2O═HClO+NaHCO3
(5)已知Ksp(CaF2)=1.5×10-10,将0.1mol•L-1的NaF溶液和0.1mol•L-1的CaCl2溶液等体积混合,则下列说法正确的是①(填序号)
①两溶液混合后有CaF2沉淀生成
②升高混合溶液的温度,Ksp(CaF2)不变
③溶液中一定存在c(F-)=c(Ca2+)
④向溶液中加入Ca(NO3)2固体,CaF2的溶解度不变.
| 溶质 | NaHCO3 | Na2CO3 | NaF | NaClO |
| pH | 8.4 | .6 | 7.5 | 9.7 |
(2)将CO2通入0.1mol•L-1的Na2CO3溶液中,至溶液呈中性,则溶液中2c(CO32-)+c(HCO3-)=0.2mol•L-1(忽略溶液体积变化)
(3)常温下,向0.1mol•L-1的HF溶液加水稀释的过程中,下列表达式的值变大的是C
A.c(H+) B.c(H+•c(OH-) C.$\frac{c(O{H}^{-})}{c({H}^{+})}$ D.$\frac{c({H}^{+})•c({F}^{-})}{c(HF)}$
(4)向84消毒液中通入少量的CO2,发生反应的化学方程式为NaClO+CO2+H2O═HClO+NaHCO3
(5)已知Ksp(CaF2)=1.5×10-10,将0.1mol•L-1的NaF溶液和0.1mol•L-1的CaCl2溶液等体积混合,则下列说法正确的是①(填序号)
①两溶液混合后有CaF2沉淀生成
②升高混合溶液的温度,Ksp(CaF2)不变
③溶液中一定存在c(F-)=c(Ca2+)
④向溶液中加入Ca(NO3)2固体,CaF2的溶解度不变.
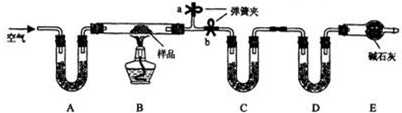

 .
.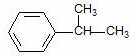 .
.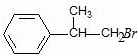 、
、 .
.