题目内容
3.有一含NaCl、Na2CO3•10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数.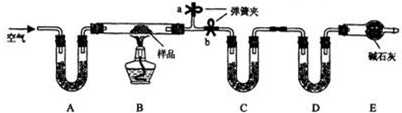
(1)加热前通入空气的目的是赶走装置中含有水蒸气和二氧化碳的空气.
(2)装置C、D中盛放的试剂为CCaCl2(或P2O5等)、D碱石灰.
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将偏低(填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将无影响;若撤去E装置,则测得Na2CO3•10H2O的含量将偏低.
(4)若样品质量为25.0g,反应后C、D增加的质量分别为9.9g、2.2g,由此可知混合物中NaHCO3的质量分数为33.6%.
分析 将混合物加热会产生H2O(g)、CO2等气体,应在C、D中分别吸收,由干燥剂的性质知应先吸收水,再吸收二氧化碳,即C中的干燥剂吸水后不能吸收CO2;由D的增重(NaHCO3分解产生的CO2的质量)可求出NaHCO3质量.由C的增重(Na2CO3•10H2O分解产生的H2O及已经知道的NaHCO3分解产生的H2O的质量)可求出Na2CO3•10H2O的质量,从而求出NaCl的质量;故应在实验前想法赶出装置中的空气,关键操作应是赶B中的空气,所以关闭b,打开a就成为操作的关键,缓缓通入则是为了赶出效果更好;E中碱石灰可防止外界空气中的H2O(g)、CO2进入装置D影响实验效果,
根据以上分析进行解答(1)(2)(3);
(4)装置D中增加的质量为二氧化碳的质量,根据反应方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O计算出碳酸氢钠的质量,再计算出碳酸氢钠的质量分数.
解答 解:(1)本实验中需要分别测定反应生成的二氧化碳和水的质量,所以实验前必须将装置中的水蒸气和二氧化碳赶走,避免影响测定结果;操作方法为:关闭b,打开a,缓缓通入空气,直至a处出来的空气不再使澄清石灰水变浑浊为止,
故答案为:赶走装置中含有水蒸气和二氧化碳的空气;
(2)装置C吸收Na2CO3•10H2O和NaHCO3分解生成的水蒸气,可以使用无水CaCl2、P2O5等;装置D吸收碳酸氢钠分解生成的二氧化碳,可以用碱石灰,
故答案为:CaCl2(或P2O5等);碱石灰;
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则m(H2O)增加,使Na2CO3•10H2O和NaHCO3的含量偏高,NaCl的含量偏低;若B中反应管右侧有水蒸气冷凝,测定碳酸钠的质量是根据装置D中质量变化计算的,与水蒸气的量无关,则测定结果中NaHCO3的含量不变; E中碱石灰可防止外界空气中的H2O(g)、CO2进入装置D,若撤去E装置,则测定的碳酸氢钠的质量偏大,碳酸氢钠分解生成水的质量偏高,而Na2CO3•10H2O的测定是根据生成水的总质量计算的,则测得Na2CO3•10H2O的含量将偏低,
故答案为:偏低;无影响;偏低;
(4)若样品质量为25.0g,反应后C、D增加的质量分别为9.9g、2.2g,则碳酸氢钠分解生成的二氧化碳的质量为2.2g,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
168 44
m(NaHCO3) 2.2g
m(NaHCO3)=$\frac{168×2.2g}{44}$=8.4g,
混合物中NaHCO3的质量分数为:$\frac{8.4g}{25.0g}$×100%=33.6%,
故答案为:33.6%.
点评 本题综合考查元素化合物性质、测定混合物中各成分的质量分数,题目难度中等,解题时必须结合实验装置和物质的性质进行综合分析,综合考查学生实验能力和分析能力,注意把握物质的性质以及实验原理.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案| 选项 | 含氧化合物 |
| A | K2O2 |
| B | H2O2 |
| C | Na2CO3 |
| D | Na2O2 |
| A. | A | B. | B | C. | C | D. | D |
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(1)在③~⑦元素中,原子半径最大的是Ca(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式),呈两性的氢氧化物是Al(OH)3(填物质化学式);
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(4)用电子式表示元素③与⑧形成化合物的过程
 .
.(5)写出将⑨元素单质从海水中(离子形式存在)提取所涉及到的三个步骤的离子方程式,第一步:Cl2+2Br-=2Cl-+Br2第二步:Br2+SO2+2H2O=4H++SO42-+2Br-; 第三步Cl2+2Br-=2Cl-+Br2.

| A. | 反应①与反应④均是取代反应 | |
| B. | 反应②与反应③均是加成反应 | |
| C. | 反应②中产物的结构简式为CH2BrCH2CHClBr | |
| D. | 反应③、④表明硫酸是乙烯与水反应的催化剂 |
